Теперь нам предстоит разобраться с тем, что мы должны понимать под понятием «температура». Как выяснилось, в понятие температура в различных случаях вкладывается различный смысл. Когда рассматривается уравнение Клапейрона Менделеева, то там где речь должна идти о теплоте, в уравнение входит температура, а когда речь идёт о равенстве температур различных тел в состоянии термодинамического равновесия, температура уже должна иметь размерность не теплоты
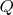
[Дж], а импульса
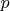
[

]. Ещё, мы привыкли называть температурой ту величину, которую измеряет термометр.
Что же в действительности измеряет термометр?
Рассмотрим ртутный или спиртовой термометр. При нагревании ртуть или спирт расширяются. Это расширение связано с тепловой энергией рабочего вещества термометра или с импульсом? Поскольку давление связано с тепловой энергией, естественно предположить, что расширение вещества с нагреванием связано с тепловой энергией. Теперь вопрос: а как зависит объём рабочего вещества термометра от температуры? Мы бы смогли ответить на этот вопрос, если бы заранее знали что такое температура, и умели бы её измерять. Мы создаём прибор, для измерения температуры, не зная, что такое температура. Кто нам сказал, что расширение тел должно зависеть линейно от температуры? Пример с водяным термометром показывает явную нелинейность вблизи четырёх градусов по Цельсию. Почему мы должны считать, что для других веществ зависимость должна быть линейная?
По крайней мере, термометр годится для того, чтобы с его помощью мы могли бы определить одинаковость состояния различных тел, при достижении ими теплового равновесия.
Снова рассмотрим сосуд с перегородкой разделяющей водород и азот. Начальные условия таковы, что температуры и давления этих двух газов одинаковы. Увеличим температуру в помещении и подождём достаточное время, чтобы установилось тепловое равновесие. Теперь, наш термометр показывает уже другую температуру (и везде одинаковую). Количество теплоты, которое нужно затратить для нагревания сосуда с газом, зависит от теплоёмкости сосуда и теплоёмкостей газов. Теплоёмкость сосуда, допустим, известна, и её можно учесть. Обратим внимание на теплоёмкости газов.
В новом состоянии равновесия средние модули импульсов частиц водорода и азота снова одинаковы, они возросли на одну и ту же величину. Приращение тепловой энергии водорода в 14 раз больше чем приращение энергии азота, т.к. скорости частиц водорода выше скоростей частиц азота. Отсюда следует, что теплоёмкость водорода должна быть примерно в 14 раз больше теплоёмкости азота.
Далее, поскольку нагревание происходило при постоянном объёме, и количество тепла принятого водородом больше, чем азотом, то и удельная теплота (а, значит, и давление) водорода стало выше, чем у азота. Термометры, тем не менее, покажут одинаковую температуру, т.к. газы в состоянии термодинамического равновесия. Что же измеряет термометр? Явно не удельную теплоту.
Показания термометра пропорционально изменению объёма рабочего тела термометра (ртути или спирта), принято считать, что изменение объёма зависит линейно от теплоты, принятой рабочим телом термометра.
Так вот, рабочее тело термометра до тех пор будет принимать (или отдавать) теплоту, пока средние импульсы частиц (по модулю) измеряемой среды и рабочего тела термометра не уравняются. Поэтому термометры покажут одинаковую «температуру» водорода и азота, если они находятся в равновесном состоянии между собой. Но, между энергией и импульсом частицы зависимость нелинейная, такая же нелинейная зависимость должна быть между теплотой и температурой, если принять за размерность температуры размерность импульса. Термометр можно отградуировать в импульсах, но тогда шкала его должна быть нелинейной (квадратичной).