Позвольте возобновить тему
https://dxdy.ru/topic130202.html Мне кажется, что при объяснении школьникам поверхностного натяжения речь должна идти не просто об энергии, а о свободной энергии, которая помимо энергетической составляющей (в общем случае - энтальпийной) включает в себя и энтропийную составляющую. Последняя в случае неравновесных процессов (а бывают ли другие в природе?) играет немаловажную роль. Не знаю, изучают ли сейчас энтропию в школе, но о ней есть книжка для школьников
Дж. Фен. Машины, энергия, энтропия.Рассмотрим в качестве примера естественную эволюцию формы капли жидкости от, например, эллипсоида вращения, до шара. Влиянием гравитации на форму капли пренебрежем вследствие малого объема капли.
Формула для расчета поверхностного натяжения жидкости
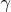
выглядит следующим образом:

,
где
F - свободная энергия Гельмгольца термодинамической системы (в нашем случае капли жидкости),
A - площадь поверхности капли.

по определению, где

- внутренняя энергия т/д системы,

- ее температура,

- энтропия.
Далее для простоты будем использовать значки обычных дифференциалов, не забывая, что

.
 dS
dS разложим на два слагаемых:

,
где

- изменение энтропии, обусловленное обменом т/д системы веществом и энергией с внешней средой, а

- изменение энтропии, обусловленное необратимыми (неравновесными) процессами внутри системы.
В нашем случае полагаем, что

.
Изменение внутренней энергии
dU также равно нулю (работа ни самой системой, ни над системой не совершается - эволюция формы капли идет самопроизвольно и беспрепятственно подобно расширению сжатого газа в вакуум, температура постоянна).
В итоге получаем формулу:

Таким образом, в рассмотренном случае изменение площади поверхности капли обусловлено исключительно энтропийным фактором. Температура капли поддерживается постоянной, так как теплота, возникшая в результате необратимого процесса уменьшения площади поверхности капли, уходит в окружающую среду. По крайней мере так написано в
И. Пригожин, Д. Кондепуди. Современная термодинамика. От тепловых двигателей до диссипативных структур. - М.: Мир, 2006 (см. стр. 132).
Понятно, что в реальности всё намного сложнее. По-видимому, процесс эволюции капли не является "абсолютно неравновесным", если можно так выразиться, и изменение внутренней энергии может иметь место наряду с изменением энтропии. Но тем не менее о последней забывать не стоит.
Школьников, по-видимому, не стоит грузить понятиями свободной энергии Гиббса и Гельмгольца, но можно привести формулу энтропии:

и объяснить на простом примере, что такое термодинамическая вероятность.
Что скажете? Сильно не уверен, что я прав. Прошу вмешаться специалистов. В особенности интересует, что скажет
munin, затронувший эту столь интересную тему.



