Здравствуйте, уважаемые товарищи. Спасибо, что ответили на мои вопросы.
![$\mathrm{K_3[Fe(CN)_6]}$ $\mathrm{K_3[Fe(CN)_6]}$](https://dxdy-02.korotkov.co.uk/f/5/0/1/5017dccf7f8153d0e976a209d65e7d6a82.png) kda_ximik
kda_ximik да я до комплексных солей ещё не дошёл. А можно ли раскрыть такие квадратные скобки или нет?
используют приливные электростанции
Да я об этом немного слышал.
Полтергейст, тут и к бабке не ходи.
Значит Вы считаете, что никакого полёта на Марс нет и что это всё выдумка? Что же я читал, что американцы инсценировали в прошлом столетии высадку на Луну и оснастили это событие фотографиями, сделанными голивудскими фотографами. Так что всё может быть.
Ну что же а теперь я хочу вернуться к заданному мне раньше примеру и решить его. Потому, что я такие примеры должен решать. А лучше это сделать под руководством таких опытных товарищей, как Вы. Потому, что можно вовремя избежать многих ошибок и извлечь полезные уроки. И к тому же у меня пропадает страх того, что я решу не правильно, а мне будет казаться правильно. Ведь в учебниках отсутствует почти всегда в ответах ход решения многих задач.
Для тренировки попробуйте расставить степени окисления в следующих веществах:

,

,

,

,

,

,

,

,

,

,

,

,

,

,

,

,
![$\mathrm{K_3[Fe(CN)_6]}$ $\mathrm{K_3[Fe(CN)_6]}$](https://dxdy-02.korotkov.co.uk/f/5/0/1/5017dccf7f8153d0e976a209d65e7d6a82.png)
,
Решение.
1.

2.

3.

4.

В этом примере я укажу логику своего решения. Натрий находится в 1-й группе, значит у него степень окисления не м.б. больше 1.
2 атома натрия имеют степень окисления

. Соответственно, если натрий отдаёт 1 электрон, то столько же примет сера. А сера - это элемент с переменной валентностью. Но мне это уже не к чему, так как мне известна постоянная степень окисления одного из элементов и я по сере могу эту степень окисления уравнять.
5.

6.

7.

Я решил этот пример так потому, что по другому решить я не знаю как. Правда что-то я несовсем пойму почему у марганца степень окисления

получилась. Ведь он стоит во второй группе, и у него должна быть постоянная степень окисления 2.
Другое дело, что можно записать и подругому - но тогда теряется логика в уравнение степеней окисления:

Тут получается, что 3 электрона отняли, но а степень окисления у кислорода -8 (на 4 атома). Такого ведь быть не может.
8.

Тут видимо необходимо раскрыть скобки.

По электроотрицательности: магний, фосфор, кислород.
По электронам на внешнем уровне: магний 2, фосфор 5, кислород 6.
Итак мы видим, что

На 4 странице я уже решал эти 8 примеров и в некоторых были ошибки я их исправил. Ну если неправильно, поправьте. Видите, до меня туго доходит.
9.

Тут только натрий имеет постоянную степень окисления. У бария и кислорода переменные со.
Но нам надо ведь найти равно между ионами. Значит я пока что интуитивно пользуюсь методом подстановки. Вот, что у меня получается:

10.

Опять же решил с помощью интуитивной подстановки:

Хотя мне не понятно, почему углерод ничего не отдаёт и не принимает, ведь он входит в данное соединение. Но похоже тут в реакцию он не вступает - потому, что по другому степени окисления тут не уравняешь.
11.


12.

Тут я могу решить двумя способами:
а)

б)

А всё дело в тому, что Ксенон стоит в 8 группе, значит это инертный газ. И он может иметь высшую степень окисления -

, а низшую степень окисления

(низшая степень окисления равна 8 минус номер группы, в которой находится элемент)
Но я думаю, что тут возможно какая то загвозка ещё - потому, что в таблицах электроотрицательности электроотрицательность ксенона отсутствует. Так возможно даже, что такое соединение невозможно.
13.

Магний имеет постоянную со

. Железо стоит в 8 группе. Значит максим. со

мин

Водород имеет тут со
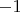
т.к. у него больше электроотрицательность. Значит методом интуитивного подбора:

14.

По другому я решать не умею пока ещё. Вспоминаю, что как-то можно, но знания путаются ещё. Раскрою скобки:

Тут кислород сильнее по электроотрицательности. Значит он принимает электроны у других.
Но в том то и дело, что тут не получается уравнять со, если не предположить, что хром ничего не отдаёт и не принимает. Ну короче говоря решить у меня этот пример не получается.
15.

Азот тут хоть и стоит первым, но по электроотрицательности он сильнее, чем хлор и водород. Значит он то и будет отрывать электроны у других:

Не знаю правильно ли я решил. Азот в пятой группе, значит у него степень окисления тут

. У водорода

Осталось найти - сколько у хлора. Хлор в 7 группе. Значит максим. со

, минимальная
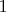
. Но подходит тут как раз
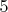
.
16.

Не знаю, как это решить - мне неизвестна электроотрицательность урана. О ней почему-то в таблице не сказано.
17.
![$\mathrm{K_3[Fe(CN)_6]}$ $\mathrm{K_3[Fe(CN)_6]}$](https://dxdy-02.korotkov.co.uk/f/5/0/1/5017dccf7f8153d0e976a209d65e7d6a82.png)
Мне уже объяснял
kda_ximik, что это за соединение. Но понять такое я пока ещё не готов. Я даже не знаю, как тут раскрыть эти квадратные скобки. Поэтому решить этот пример я не могу.
Дорогие товарищи! Я очень надеюсь на Вашу помощь - если Вы мне не поможете разобраться в окислительно-восстановительных реакциях - то самостоятельно я этого сделать не смогу. Слишком много непонятного для меня - особенно пугает большое количество соединений, которые пока что мне зазубрить не удается.



