А вот, как я, примерно, представляю электростатический потенциал
Видимо, всё же, никак не представляете. Раз цитируете чей-то популярный рассказ о том, что такое электризация. Это отнюдь не объяснение, что такое потенциал.
Попробую изложить.
По определению: потенциал электростатического поля в данной точке - это отношение потенциальной энергии точечного заряда, помещённого в эту точку, к величине этого заряда. Так (или почти так) написано и в Википедии. Непонятно? Давайте проведём аналогию с механической системой.
Рассмотрим небольшое тело (материальную точку) некоторой массы
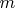
в поле тяжести Земли. Потенциальная энергия этого тела

(надеюсь, помните). Разделим эту величину на массу материальной точки (аналог заряда). Останется величина

. Это - аналог потенциала. Значит, потенциал можно наглядно представить себе как "высоту положения" заряда во внешнем поле (с некоторым коэффициентом). Кстати, если электростатическое поле однородно, то можно определить потенциал как произведение

, где
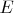
- напряжённость поля, а

- координата заряда, отсчитываемая вдоль оси, направленной противоположно полю. Так что аналогия с механикой полная:
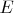
вместо
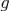
,
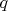
вместо
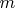
,

вместо
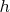
.
Ограниченность этой аналогии лишь в том, что масса всегда положительна, гравитационная сила, действующая на неё, направлена всегда согласно направлению самого гравитационного поля. А заряды бывают двух типов: положительные и отрицательные. Наша аналогия распространяется без каких-либо поправок на положительные заряды. А для отрицательных зарядов поле как бы направлено в обратную сторону. Вот и вся разница.
Подобно тому, как материальная точка, не удерживаемая никакой силой, станет "падать", то есть перемещаться в область с меньшим значением потенциальной энергии, так и положительные заряды, способные свободно перемещаться во внешнем поле, устремляются в область более низкого потенциала. Отрицательные, напротив, - более высокого.
Вот такая аналогия.
Теперь конкретно: в чём Вы были неправы.
Вернёмся ещё раз к гравитационному полю, зафиксировав предварительно уровень, принимаемый за нулевой. Например, уровень моря.
Совершенно очевидно, что о разности величин

можно говорить
для любой пары точек. Совершенно не обязательно при этом, чтобы одна из них находилась выше уровня моря (в области положительного "потенциала"

), а другая - ниже уровня моря (в области отрицательного "потенциала"

). Точно так же и в случае электростатического поля: для любой пары его точек можно говорить о разности потенциалов. Не обязательно при этом, чтобы одна из этих точек находилась в области положительного потенциала, а другая - отрицательного.



