ЭО -- это, по-сути, способность перетягивать на себя межатомную электронную плотность. А вот электрохимический потенциал -- это, по-сути, энергетический выигрыш от конкретной электрохимической (полу)реакции в конкретных условиях.
Сам себе поражаюсь, но кажется я действительно начинаю понимать и такие вот очень специфические пояснения. Более того нахожу его ещё более понятным, чем страницей ранее. Законспектировал для полного осознания...
То есть ЭО - это
способность какого-либо одного вещества, а ЭП - это
процесс в котором участвует как минимум два вещества?
Активность уже ближе и она действительно имеет отношение к делу, но лучше не стоит на подобном уровне интерпретации приплетать её сюда. Там не так всё просто даже с определением.

(хотя Вы, возможно перепутали само понятие "активность" с "ряд активностей металлов", слово это имеет во втором случае другой смысл и от слов "ряд" и "металлов" очень сложно отделяется).
Так в том-то и дело, что хочу разобраться во всех этих понятиях, которые участвуют при обмене электрохимическим потенциалом, если можно так сказать. Просто встречаю в разных объяснениях разные подходы, вот и путаюсь во всех этих таблицах, не зная какими же реально нужно пользоваться.
То есть имеем следующие таблицы:
1. таблица электроотрицательности
2. таблица электрохимического ряда напряжения металлов
3. таблица электродного потенциала
4. таблица стандартного электрохимического потенциала
5. электрохимический ряд активности металлов
-- и судя по вашему ответу есть еще какая-то отдельная активность металлов...
Ваши объяснения про ЭО И ЭП, позволили мне разобраться с пункати 1 и 3(похоже). Подозреваю, что 4 и 2 пункт также относятся к рассмотренному вами ЭП ( электрохимическому потенциалу), но нет в этом уверенности. В общем, помогите, для начала, пожалуйста, распределить эти таблицы хотя бы признаку разности понятий...
К сожалению, картинка неправильная.
Во-первых, такое ощущение, что обе пластинки находятся в одной ёмкости, погруженной в

.
В гальваническом элементе Якоби-Даниэля должна течь реакция

. У Вас, очевидно не хватает одного реагента, поэтому так реакция заведомо точно не пойдет.

Картинку стянул вот
отсюда в таком вот виде:
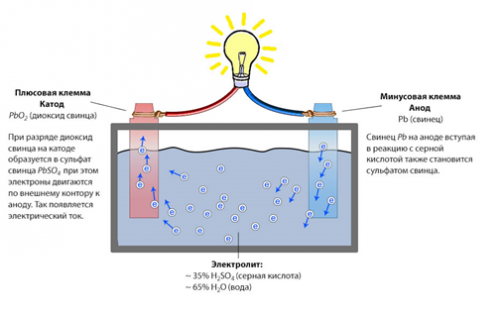
и попытался упростить, взяв за основу два разных в своем потенциале металла... и я там в этих кружочках и буковок-то не разглядел, посчитав, что именно так обозначаются ионы растворяющегося металла...
А смоделировать я пытался простейший элемент вольта, чтобы на его основе понять саму модель обмена электрохимическим потенциалом. Я то больше всего времени убил, чтобы разобраться где там, все-таки анод-катод, как все это соотносится с плюсом и минусом на схемах и куда там на самом деле бегут электроны по внешнему контуру, ну и видимо понаделал ошибок в картинке в другой области...
На самом деле я пока вижу процесс так, подкорректируйте или дополните, пожалуйста если что не так:
И цинк и медь опускаем в разбавленную серную кислоту. Цинк - анод (но обозначается минусом), а медь - катод (обозначается плюсом)
Цинк растворяется и некоторые его ионы (вот что это за соединения в данном примере так пока и не осознал) оседают на медной пластинке, тем самым как бы заряжая ее. У самого цинка остается избыток свободных электронов, которые в электролите ни в коем случае не переносятся. То есть заряжается отрицательно. И вот когда мы соединяем два металла поверху проводником, избыток электронов бежит туда, где их не хватает. Вот как-то так...
К слову, я к этому элементу Якоби-Даниэля уже и так и этак подходил, но никак так и не могу понять зачем все эти сложности с разделением растворов и соляным мостиком. Видимо я действительно, что-то неправильно понимаю в процессе, который постарался описать выше...