Так почему это ошибка то?
Потому что нулю не равно.
-- 19.06.2014, 16:31 -- в первой производной

уже предполагается константой, а поэтому вторая производная от константы

Ничего подобного. Наверху во второй производной стоит попросту температура, ее производная по объему при постоянной энтропии вовсе не нулевая.
То есть когда берется производная внутренней энергии по энтропии, то объем считается постоянным, в результате этого дифференцирования получается функция, которая все равно может зависить от объема и уже при повторном дифференцировании по V может получится вовсе не 0 т. к. объем не обязательно может быть в первой или нулевой степени после первого дифференцирования (т. е. не

, а, например,

). Так?
-- 19.06.2014, 13:41 --Тогда будут разные удельные объёмы
Ну и что? Я пишу просто про объем, не про удельный. А через удельный внутренняя энергия не определяется.
Есть у меня такая гипотеза, что если, например,
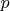
и

постоянны, то и температура, и энтропия, и свободная энергия, и потенциал Гиббса, и энтальпия определяются однозначным образом. Тоже самое если фиксировать
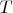
и
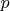
или
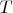
и
