Теплота
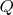
это не функция состояния, а функция процесса, поэтому писать

некорректно, правильно

. Это важно, так как за этим стоит определенный смысл.
Вероятно я что то не правильно понимаю.
Начнем по порядку.
1. Рассмотрим опыт Крушева. Берем адиабатический сосуд, перегороженный подвижным прозрачным поршнем с вакуумной прослойкой, на две камеры. Камеры заполнены идеальным газом. При перемещении поршня в первой камере происходит снижение давления, во второй камере происходит увеличение давления. Соответственно в первой камере при снижении давления происходит адиабатическое охлаждение газа, а во второй камере, в результате увеличения давления происходит адиабатический нагрев газа. При неподвижной фиксации поршня, в результате перехода тепловой энергии в виде излучения через прозрачный поршень, происходит постепенное выравнивание температур в первой и второй камерах.
В адиабатическом сосуде с подвижным прозрачным поршнем имеющим вакуумную прослойку можно моделировать все термодинамические процессы -- изотермические, адиабатические, изохорные, изобарные.
При этом важно, что передача тепловой энергии происходит только излучением через прозрачный поршень.
Зависимость изменений состояний идеальных газов от количества поглощаемой--излучаемой тепловой энергии свидетельствует, что состояние идеальных газов определяется не только давлением, молярным объемом, температурой, но так же и количеством поглощенной молярной тепловой энергии -
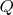
.
Таким образом, молярная тепловая энергия
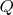
это функция не процесса, а именно состояния идеальных газов. Из опыта Крушева видно, что между молярной тепловой энергией, давлением, молярным объемом и температурой имеются строго определенные зависимости.
Поэтому, я считаю, что молярная тепловая энергия может обозначаться именно как
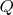
, аналогично давлению
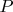
, молярному объему

, температуре
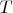
.
2.
например, для одного моля идеального газа в изобарном процессе:

. Вот Вам и связь приращения теплоты с приращением объема (приращение давления естественно нуль

).
Я считаю, что у Вас ошибка -- Вы дважды считаете расход тепла на увеличение одного и того же объема газа. Дело в том, что первичными состояниями газов являются молярная тепловая энергия
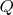
и давление
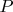
. Температура
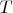
и молярный объем

являются вторичными от молярной тепловой энергии и давления.
-- Ср апр 18, 2012 22:06:22 --я хочу перейти на определение зависимостей состояний средних энергий электронов в атомах.
Тут все просто пока кТ много меньше разности энергий между основным и возбужденным состоянием, все электроны находятся в основном состоянии, и их средняя энергия равна энергии основного состояния.
Ошибочная у Вас теория.
Не так все просто.
Дело в том, что любой энергетический уровень в атоме является основным. И на любом энергетическом уровне без внешнего воздействия электроны могут находиться неопределенно долгое время. Для перехода электронов по энергетическим уровням электрон должен получить внешнее воздействие. Для перехода на более высокие энергетические уровни электрон должен захватить фотон с энергией разности энергетических уровней. Для перехода на более низкие энергетические уровни электрон должен получить тормозное возмущение, с энергией разности энергетических уровней.
Например посмотрите Ридберговские атомы. В вакууме, при отсутствии неупругих столкновений между атомами, в результате захвата фотонов, электроны в атомах постепенно переходят на высокие энергетические уровни.
http://www.prao.ru/History/history_6.htmlИсследования РРЛ линий привели к получению ряда принципиально новых, важных для физики и астрономии результатов. Было установлено, что в разреженной межзвездной среде атомы, как квантовые системы, могут существовать до уровней возбуждения
n ~ 1000, достигая размеров ~ 0.1 мм. Излучаемые (поглощаемые) ими спектральные линии можно наблюдать на Земле в широком диапазоне радиоволн от миллиметровых до декаметровых.
Интересно отметить, что Н.Бор в известной мере предвидел, что наиболее высоковозбужденные атомы можно наблюдать именно в космосе. В своей работе "О спектре водорода", объясняя почему в лабораторных условиях не удается наблюдать столь же высокие члены бальмеровской серии, как в спектре небесных тел, он писал: "Только при очень низких давлениях большие электронные орбиты не будут возмущаться электрическими силами соседних атомов; давление должно быть столь низким, что в гейслеровской трубке обычных размеров мы не можем получить свечение достаточной яркости. Однако можно предполагать, что в небесных телах водород может находиться в крайне разрежении на огромных просторах" [25]. Как мы сейчас видим, предположение Бора было весьма прозорливым, хотя он, конечно, не мог предвидеть того, что наиболее возбужденные атомы будут зарегистрированы методами радиоастрономии. Во время создания им квантовой теории атома ее просто не существовало.