Судя по предложенному мной тексту, после того как ионы металла были оторваны водой от своей основы, они приобрели положительный заряд и опять вернулись назад к поверхности металла, но уже в виде отдельного слоя положительно заряженных ионов. Так этого не происходит? А если все-таки происходит, почему эти вернувшиеся ионы заново не интегрируются в поверхность как раньше, раз уж снова притягиваются к ней? Гидратируются они что ли?
Вам уже, конечно,
arseniiv ответил:
Они и возвращаются тоже. Есть такая штука как динамическое равновесие.

Две обратные реакции идут одновременно, и если условия достаточно долго не менялись, устанавливается какое-то распределение концентраций ионов в зависимости от расстояния до металла.
я всего-лишь этот ответ раскрою чуть-чуть поподробнее. Во-первых, да, конечно же гидратируются (я Вам уже об этом писал, используя аналогию с шубой). Бывает, что в воде находятся какие-то еще ионы или молекулы, которые могут образовывать более прочные комплексы с ионами металлов (например, ЭДТА какой-нибудь). Ведь, не забываем, что природа заряженное нечто не очень любит, поэтому у поверхности будут так же в определенных количествах тусоваться и противоионы, которые могу образовывать с ионами прочные или не очень комплексы.

Во-вторых, конечно, новообразованные ионы будут и возвращаться и улетать. Динамическое равновесие, конечно, не обязательно (особенно на начальных стадиях процесса), но суть в том, что в каждый момент времени будет образовываться некоторое распределение ионов в зависимости от расстояния от пластинки (т.е. одни будут мигрировать в одну сторону, другие в другую). Представим себе картинку с распределением поподробнее. Допустим, что у нас уже установилось это равновесие (и диффузия идет достаточно быстро). Около поверхности, допустим, ионов металла будет больше, т.к. там нужно компенсировать заряд этого куска металла. Убегать от поверхности им не выгодно, т.к. будет ослабляться взаимодействие с ней. Поэтому, по мере того, как мы будем уходить от поверхности их концентрация будет падать до того момента, когда они совершенно не будут эту поверхность чувствовать. Тогда их концентрация дальше этого расстояния будет приблизительно постоянной и соответствовать объемной концентрации в данный момент времени.

С противоионами, соответственно, будет обратная зависимость -- их количество будет от объема к поверхности падать. Картинкой (примерной) данной ситуации может служить иллюстрация двойного электрического слоя (ДЭС):
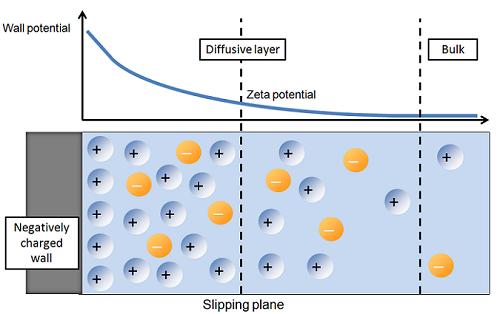
В случае, если диффузия будет медленная, но при этом будет динамическое равновесие, то там будет (как мне кажется) нечто похожее.

А в неравновесных случаях картинка будет конечно существенно более сложной и разнообразной.

С третьим стало чуть яснее, но всего лишь чуть. Но крайней мере я понял, что эти понятия все-таки разные, и что способность атомов оттягивать к себе электроны других атомов это нечто другое, чем электродный потенциал, который похоже и размечается в таблице напряжений металлов. Как-то так?
Меня в данном случае интересует в общем-то то, каким таким конкретным физическим свойством различаются цинк и медь например, раз один металл более склонен отдавать свои электроны, чем другой?
Ну давайте поймем, что такое электроотрицательность. Это по-сути (как-то выраженная) величина, показывающая способность
атома (это важно!) отнимать электроны. Т.е. вот у нас есть 2 атома. Мы поставили один около другого и, допустим, они образовали хим. связь. У них теперь есть общая электронная пара. И тот, что с большей ЭО, перетянул её ближе к себе. Но, весьма забавно, что если мы введем ЭО не для одиночного атома, а какой-то их комбинации, то она будет отличаться в зависимости от того, как эти атомы расположены друг относительно друга, в зависимости от электронного состояния этого куска (да даже в зависимости от того, к какому атому мы будем присоединять, например, в ионе азида

-- там центральный атом азота неэквивалентен двум крайним).

Конечно, концепция ЭО отлично работает для двухатомных систем, её можно (приближенно) использовать для оценки того, кто как заряжен в молекуле, но чем сложнее система тем меньше эта величина (ЭО) будет иметь отношение к её свойствам (т.е. если и будет зависимость, то она будет от стольких других более важных параметров зависеть, что проще считать, что ЭО не вносит особо ничего).
А теперь попытаемся потять про стандартных электрохимический потенциал. У нас есть брусок. В нем не один и не два, а OVER9000 атомов, они расположены как-то по разному (разные симметрии, разные решетки), у них различные состояния электронного газа. Плюс, т.к. эти реакции написаны для конкретного состояния в конкретной среде (в воде), то конечные состояния ионов в воде будут тоже играть огромную роль (

как раз и стоит на первом месте из-за очень экзотермичной реакции гидратации его ионов). Так что ЭО тут не в кассу (по крайней мере из неё что-то из наблюдаемых явлений сложно прямо так объяснить).
Если попросту, то силой с которой самый вешний электрон удерживается на своей орбитали ядром.
В случае с бруском этих металлов это не особо играет роль (там всё равно электронный газ -- там всё существенно сложнее).

Ну и естественно что, количество тех электронов равно заряд ядра минус один.
Простите, я не понял в чём тайный смысл этой фразы...




