Конечно же нет! Теплоемкость будет разная если нагревать при постоянном объеме или при постоянном давлении. А может же и одновременно меняться и давление, и объем при нагревании. Тогда, вообще говоря, теплоемкость не будет постоянной. Простейший пример: часть процесса идет при постоянном давлении, а другая часть -- при постоянном объеме, в части процесса одна теплоемкость, в другой части --- другая.
Понял вас, спасибо :) Значит, теплоемкость свободно может меняться в ходе процесса над газом.
И того, и другого.
Хм... А действительно ли будет коэф. политропы зависеть от свойств газа?
Т. е. по-моему, главное уравнение политропы - это:

. Ну, и вытекающие из него

и

. То есть если взять любое из этих уравнений за основу, то для
идеального газа любой природы (и породы

) будет выполняться

, и два остальных уравнения выведутся "автоматически", т. к. число степеней свободы не влияет на величину давления, и уравнение Менделеева-Клапейрона действует для всех идеальных газов одинаково. При этом если мы посмотрим на формулу теплоемкости политропного процесса:

, то увидим, что теплоемкость политропного процесса зависит от
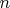
, а также от
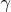
. То есть влияние газового состава здесь учитывается только через
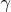
. То есть
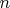
задается как критерий протекания самого процесса, который мы жестко устанавливаем в уравнении

. Ну а на теплоемкость газа будет влиять уже и то,
как именно будет протекать наш процесс (какое
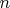
будет "рулить" нашим процессом

, и состав газа, то есть его
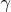
. Таким образом, по-моему, влиять на
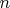
будут именно: темп процесса, интенсивность подачи/отдачи тепла, интенсивность изменения давления на границе газа и, как следствие, интенсивность изменения объема газа в процессе. А от состава газа будет зависеть уже только теплоемкость
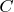
.
В случае же, когда у нас
реальный газ, дело обстоит сложнее. У нас опять же имеется какой-либо политропный процесс вида

(и здесь мы полностью игнорируем то, что у реального газа уравнение М.-К. "не совсем работает", т. к. нам главное получить

, чтобы считать процесс политропным. Т. е. конечно, тогда теплоемкость реального газа будет меняться с течением времени, но думаю, что это очень сложно учесть и вывести какое-либо уравнение процесса для реального газа, при котором его теплоемкость

. Здесь потребуется учитывать изменение коэф. сверхсжимаемости газа
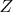
, который имеет самый разный вид у различных газов. Или же углубляться в то, как "устроен" этот коэффициент и от чего он зависит, чтобы получить более точную зависимость

. Так что я думаю, что для реальных газов "слово
политропный процесс" значит именно процесс, протекающий таким образом, что выполняется уравнение

.
Сам я, например, столкнулся с эитм в связи с тем, что модель компрессора учитывает изменение температуры так, как если бы сжатие газа протекало по политропе в согласии с уравнением

. Вот... То есть, политропным назывался именно процесс, протекающий согласно одному из трех уравнений:

,

и

. Для идеального газа они все тождественны, однако для реального газа приходится
выбирать одно, которое наиболее правдоподобно. Остальные же перевоплощаются во что-то схожее, но уже с коэффициентом
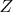
. Таким образом, если одно из уравнений в целом в достаточной мере соответствует истине, то его можно взять и использовать. Так и сделали, вычисляя изменение температуры в компрессоре при изменении давления компремируемого газа.
Лучше говорить не "теплоёмкость данного газа", а "теплоёмкость того или иного процесса над данным газом". Так меньше шансов запутать себя.
Дааа, точно :) У газа-то она непостоянная.
Конечно, теплоёмкость не зависит от времени явно, но она зависит от текущего состояния газа и от характера процесса над ним. Поскольку в разные моменты времени и состояние газа и характер процесса могут быть различными, то в этом смысле с течением времени теплоёмкость газа может измениться.
Понял вас. Да, даже у идеального газа теплоемкость в произвольном процессе может меняться. Что уж говорить о реальном газе...
Наверное, в принципе так можно себе представлять тот или иной процесс, но в чём смысл подобной модели? Это примерно то же самое, что сказать: материальная точка всегда движется с постоянной скоростью, только в разные моменты времени эта константа различна

Не проще ли будет сказать, что тело может двигаться с переменной скоростью? Так же и здесь: не проще ли допустить, что бывают и не политропические процессы?

Хах)) Да, это точно)) И проще жить будет :)
Величина
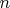
выводится из системы следующих уравнений:
- уравнение, выражающее определение теплоёмкости
- уравнение, выражающее первое начало термодинамики
- уравнение состояния газа (в простейшем случае идеального газа его роль играет уравнение Менделеева - Клапейрона или любое равносильное ему уравнение)
- уравнение, описывающего данный процесс (изобарный, адиабатический и т.д.).
То есть опять же, когда мы говорим о
реальном газе, нам уже нужно выбирать из каких соображений брать величину
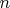
. Ведь в случае идеального газа все эти уравнения тождественны (или по крайней мере не противоречат друг другу). Так, если пытаться выразить
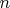
из требования к постоянству теплоемкости газа при процессе, мы получим одно уравнение, если же исходить изначально из уравнения

, то мы получим другое
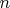
, которое не будет соответствовать постоянной теплоемкости газа. Даже если мы выберем одно из трех уравнений, описывающих политропный процесс (

,

и

, каждое из которых тождественно другому в случае идеального газа), то другое уравнение уже не будет действовать для реального газа, так что здесь понятие политропного процесса как бы претерпевает некое размытие, и мы можем понимать под ним различные варианты процесса (с

или же

или другие).
Все же некоторый смысл подобная модель имеет (как и представление переменной скорости в виде кусочно-постоянной функции) - для численного моделирования это может быть удобно.
Воооот :) Это именно то, что я имел в виду. Кусочно-линейный процесс :)
Hagrael, возможно, проще будет зайти немного с другой стороны. Состояние (равновесное) некоторой определенной массы газа с известным химическим составом (включая возможную ионизацию) полностью описывается тремя переменными - температурой, объемом и давлением. Что-то можно поменять (например, взять вместо объема плотность), но переменных все равно будет три. Соответственно, возможные состояния газа можно себе представить как точки в трехмерном пространстве, координаты в котором соответствуют этим трем переменным.
Понял вас :) То есть мы как бы строим кривую в трехмерном пространстве (иногда замкнутую, иногда нет) и по ней движимся. Интересно, а можно ли реально создать процесс, где по такой кривой свободно можно будет перемещаться влево и вправо? То есть как бы обратимый процесс?) Думаю, что да. Пускай затраченная энергия и не будет возвращена в объеме 100%, но все же затратив некоторые дополнительные ресурсы, газ можно вернуть в нужное состояние. Т. е. если изначально газ совершил работу
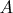
и отодвинул поршень с некоторой зависимостью

, то теперь мы сами сжимаем газ так, чтобы функция

имела тот же самый вид. Ведь по идее процессы расширения и сжатия, как бы, симметричны, да?) Хотя будь они прям абсолютно симметричны, цикл Карно был бы линией "туда, а потом сюда", а не контуром

Но у двигателя внутреннего сгорания на обратном пути поршня тепло к газу не подводится, а если подводить тепло, то, наверное, возможно создать такие условия для газа, чтобы он и впрямь пошел по обратному пути...
Затем, если мы знаем, что это за газ, у нас появляется уравнение состояния, которое позволяет выразить какую-то одну переменную через две других. Можно сказать, что в пространстве состояний уравнение состояния задает какую-то поверхность, а можно - что мы просто уменьшили число независимых переменных до двух. Уравнений состояния может быть бесконечно много (и в реальности существует немало), они описывают разные газы (в том числе и существующие в действительности), но среди них есть одно достаточно универсальное уравнение, соответствующее некоторой конкретной модели, которую принято называть идеальным газом.
То есть это как бы уравнение, описывающее "возможности" нашего газа, да?

Те точки (p, V, T)-пространства, которые доступны нашему газу. Например, как бы наш газ не хотел, он не сможет при определенных

и
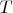
достичь сврхбольшого значения
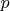
. Так, для идеального газа этим уравнением будет

, а для реального газа - другое, и область (p, V, T)-пространства также будет другой.
Уравнение процесса - это еще одно соотношение между тремя переменными, описывающее происходящие с газом изменения. Оно задает еще какую-то поверхность в пространстве состояний или еще одно уравнение, позволяющее в общем случае выразить одну из величин через две другие. Если взять систему из двух уравнений (состояния и процесса), то это позволит взять какую-то одну из трех переменных и выразить через нее две остальные (как вариант - сказать, что в пространстве состояний пересечению двух поверхностей будет соответствовать какая-то одномерная линия).
То есть именно этим уравнением мы и "вырезаем" ту линию в (p, V, T)-пространстве нашего газа, которая соответствует нашему процессу :) Так как изначально у нас было некоторое уравнение, описывающее возможности в (p, V, T)-пространстве нашего газа, уже исходя из них мы видим, как газ поведет себя в данном процессе. То есть как при данном измемнении давления и температуры у него будет изменяться объем, например.
Уравнений процесса, как и уравнений состояния, может быть бесконечно много. Но их хочется как-то классифицировать, поэтому выделяют те или иные удобные и часто встречающиеся виды. Например, изопроцессы - у которых одна из переменных во время процесса не меняется. Можно выделить также класс процессов, для которых уравнение процесса будет иметь вид степенной зависимости одной переменной от другой (и обнаружить, что для уравнения состояния идеального газа у газа, совершающего такой процесс, будет постоянной удельная теплоемкость - этот вид встречается часто и для него придумано специальное название). Но очевидно, что можно взять много произвольных (почти) видов зависимостей параметров друг от друга и получить еще много видов процессов, у которого не будет названий только лишь потому, что они редко встречаются на практике.
Да, видимо, уравнений процессов в физике газа - как рыбок в прду :) И некоторые очень спецефичны, однако все же встречаются. А политропный процесс - это лишь один часто встречающийся вид процессов, которым к тому же часто идеализируют реальные процессы, даже если в них проявляются свойства
реального газа.
Для идеального газа можно вычислить.
Записываем
Да, для идеального газа все более менее просто :) Гармоничная теория) А вот у реальных газов начинаются сложности - выбор модели, например)) И выбор идеализации того или иного процесса)
Чтобы не было слишком скучно, можно назвать ещё несколько моделей:
- газ Ван-дер-Ваальса ("первое неидеальное усложнение" модели идеального газа);
- идеальный Ферми-газ (поправка к идеальному газу с учётом квантовой механики);
- идеальный Бозе-газ (другая возможная поправка с учётом квантовой механики).
А то может сложиться в голове картинка, когда есть уравнение Клапейрона-Менделеева, и недоумение "а как же ещё?".

Да, вот мы в нефтегазе используем уравнения Пенга-Робинсона и Редлиха-Квонга) Я думал, это основные модели для описания поведения реальных газов, а их оказывается, столько

Газ Ван-дер-Ваальса (и прочие линейные по температуре уравнения состояния), кстати, удобны тем, что в них

не зависит от

.
Интересно) У Ван-дер-Ваальса, как я понял, учитывается объем молекул. Интересно, что

не зависит от

, ведь по идее интенсивность взаимодействия между молекулами с ростом температуры растет. Хотя если в целом молекулы находятся на "нейтральном" расстоянии друг от друга с нулевой силой взаимодействия, то может быть, сама амплитуда взаимодействия не так уж и важна. Но думаю, сперва нужно вообще в целом разобраться с тем, что же такое
температура у реального газа и как она связана со скоростью молекул, степенью их взаимодействия и тому подобными тонкостями :)
Угу. Хотя лучше бы не с квантовыми статистиками (дабы не запугивать ТС раньше времени), благо просто уравнений реальных газов существует вагон. Можно посмотреть, например, википедию про уравнение Дитеричи
и походить по списку уравнений состояния справа.
Дааа, глянул список))) Реально вагон и маленькая тележка уравнений. Правду говорят - прежде чем сделать изобретение - проверь список патентов

Здорово, что так много всего уже придумано и может быть использовано.
Уточню: я не предлагал смотреть, как эти уравнения состояния выводятся, я предлагал просто ознакомиться с тем фактом, что они есть. И что физика не остановилась на уровне классики и феноменологии.
Дааа, а ведь сколько усилий было сделано, чтобы сдвинуть ее с Ньютоновской точки покоя

P. S.: Извините, что давно не писал

Много всего было) Рад, что наконец-то смог собраться, сесть и ответить :)