Десятки килокельвин - это сравнение энергии связи с тепловой энергией на одну степень свободы

.
Кол по физхимии.
У нас тут, что, идеальный газ, чтобы приравнивать энтропийный эффект газовой постоянной
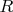
?

По ссылкам, приведённым мной выше, видно, что

диссоциации составляет десятки
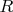
.
Для оценки газ можно приравнять к идеальному...
Вам -1 по физике ... Постоянная
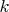
- это не газовая постоянная
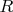
, а постоянная Больцмана (Вам без разницы моль или молекула?).. Изменение энтропии не существенно, я не вижу большой разницы в газе молекул и в газе ионов (в изменении вероятности макросостояния) ..
По ссылкам, приведённым мной выше, видно, что

диссоциации составляет десятки
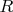
.
Какие там десятки
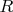
..Энергия ионизации моля

составляет порядка 1 МДж/моль!
Вам такие элементарные расчёты показывать надо?
Печально.
Прежде всего, расчёты нужны Вам, дабы убедиться в их несостоятельности...Расчёты в студию...
И ещё...Вам на заметку, выдержка из книги В.А. Киреев "Краткимй курс физической химии".
"...Эффективное образование ионов азота начинается с температуры выше 9000 К..."
По графику концентрации ионов азота(оттуда же)-при 15000 К концентрация ионов азота составляет

что составляет 1%...