Поскольку уважаемый мной
Ende попросил "дать заключение" о высказываниях
мат-ламер'a, выскажусь тут, поскольку это имеет отношение к предмету обсуждения здесь.
Во-первых, откуда вообще появляется молярный объем газа. Появляется он из уравнения Менделеева-Клайперона. Если

то есть, у нас ровно один моль газа, то

Значит, все идеальные газы имеют одинаковый объем при одинаковом давлении и температуре, и отличия для реальных газов связаны с их неидеальностью.
Во-вторых, если молекулы газа не взаимодействуют, то газ идеальный (уравнение состояния - уравнение Менделеева-Клайперона), как бы сложно не были устроены сами молекулы. Последнее утверждение не совсем очевидно, поэтому позволю себе напомнить его вывод. Заранее извиняюсь - вывод совсем не школьный.
Я буду пользоваться такими утверждениями, доказываемыми в стат. физике
1. Статистической суммой
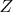
называется величина

где
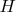
- полный гамильтониан всей системы. Интегрирование ведется по всем координатам и импульсам всех частиц.
2. Свободная энергия
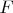
(неважно, что это такое) равна

3. Давление равно


- объем системы.
Пусть у нас есть газ, все взаимодействие в котором "находится внутри молекул". Это значит, что гамильтониан такого газа имеет вид

Значок
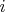
нумерует молекулы, а
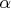
- частицы внутри молекулы. Важно, что никакого взаимодействия между молекулами нет, хотя внутри частицы взаимодействуют как угодно. Выделим координату центра масс каждой молекулы

и канонически сопряженный ей импульс

(не путать с давлением!). Тогда


Мораль: все рассуждения
мат-ламер'a о внутренних степенях свободы к обсуждаемому вопросу отношения не имели, о чем ему и сообщили другие участники. Вышеизложенного можно не знать - в школе этого не проходят, но в таком случае лучше промолчать.



