Здравствуйте, столкнулся с непониманием при выводе уравнения Клапейрона-Клаузиуса:
Пользуясь равенством химических потенциалов (
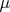
) мы приходим к следующему соотношению:
где v, s - молярные объем и энтропия.
Затем мы утверждаем, что

. Где

- это удельная теплота перехода из состояния 1 в состояние 2. (Вывод из учебника)
Однако по определению энтропии равенство

достигается только в квазистатических процессах. Но ведь это равенство применяется для общего случая. Почему это равенство верно в общем случае? Объясните пожалуйста.



