... возьмём не точки, а шарики малого радиуса. Тогда столкновения возникают с ненулевой вероятностью, и равновесное распределение быстро устанавливается.
Понятно.
Извините, тогда еще вопрос. Шарики могут сталкиваться под разными углами - от удара "в лоб", до удара по касательной.
Пусть в начальный момент скорости всех молекул равны по модулю, но направление движения молекул разное.
Этого достаточно, чтобы через какое-то время распределение скоростей стало максвелловским?
То есть столкновение шариков под разными углами автоматически приводит к распределению Максвелла, независимо от начальных условий?
Кроме вырожденных случаев как ниже.
Суть, конечно, в том, что чтобы система вела себя "по-термодинамически", в ней должны выполняться некоторые условия. Чаще всего их сводят под названием "эргодичность".
В описанном случае, ситуация, когда все шарики имеют в точности равные скорости, имеет вероятность 0. А вот если рассмотреть какие-то другие скорости, находящиеся в пределах

от этих точно равных, то вероятность такой ситуации будет уже ненулевая. И поэтому, именно такие ситуации и будут встречаться в жизни, а в них будет наступать перемешивание и установление равновесия, и достаточно быстро (

кажется).
Тут есть один момент (правда он вроде ни на что не влияет

) - любое наперед заданное распределение по скоростям имеет вероятность равную 0. Не только, когда все шарики имеют равные скорости. Потому что это точка (в фазовом пространстве ?).
А если скорости находятся в каком-то интервале - то вероятность отлична от нуля.
Вероятность выпадения в лотерею чисел 1,2,3,4 равна вероятности выпадения 1,3,5,7 и любой другой комбинации.
Если мы кидаем точки в объем, то вероятность, что они все окажутся в одной половине сосуда, а в другой половине не будет ни одной, равна вероятности любого другого распределения молекул по объему. В этом смысле нельзя говорить, что одно состояние является "упорядоченным", а другое "неупорядоченным".
Хотя..
Если мы кидаем точки в объем, то вероятность, что точка попадет в правую половину равна

. Что две точки туда попадут -

. И так далее.
А вероятность того, что точка просто попадет в объем равна 1. И для двух точек равна 1. И для
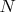
.
Поэтому вероятность состояния, когда точки соберутся в одной половине объема в

раз меньше чем, когда точки распределены по всему объему.
В этом смысле состояние "все точки в одной половине" является более упорядоченным, чем "точки во всем объеме"
Но теперь разделим сосуд на две части не прямой линией, а любой загогулистой кривой, или даже выделим подъобем любой формы, лишь бы его площадь равнялась половине всего объема. Вероятность попадания точек в такой подъобъем будет тоже

и он тоже будет "упорядоченным".
Как-то так?




