Если отрицательные ионы куда-то "диффундируются", то итоговый кристалл будет положительно заряженным??
Конечно же не будет. Во время диффузии же происходит не только движение атомов, но и химические реакции (в т.ч. и окислительно-восстановительные, с изменением заряда).
Где-то как-то да компенсируется этот несчастный заряд. Как именно -- не скажу, но вариантов можно придумать предостаточно.

Если последнее, то как компенсируется заряд?
Не знаю, честно. Заряды же (читаем: распределение электронной плотности в кристалле) не распределено дискретно между атомами, и перенос заряда между атомами не происходит "ступенчато", это всё происходит плавно. Один из вариантов подобной компенсации -- как в
теории Дебая-Хюккеля, т.е. где-то образуется в решетке

"обеднение" электронами, где-то "обогащение", в результате заряд по экспоненте спадёт при движении от сильно заряженного центра.
Можно ли на основании какой-нибудь не очень сложной теории (видимо, с молекулярными орбиталями) понять, почему железо чаще всего бывает именно двухвалентным или трёхвалентным, хотя неспаренных электронов там кажется шесть штук?
По-идее можно, но я в этом не очень силён. Да и вообще граница у железа между двухвалентным и трёхвалентным весьма слаба:

(
отсюда)
и стабильность

и

в тех же растворах очень зависит от того же pH:

По-сути, Вы ищете некоторую феноменологию, такого добра навалом, но это химия, поэтому есть куча правил и есть куча исключений.
У Шрайдера-Эткинса не нашёл, хотя, быть может, плохо искал.
Да не, вроде там такое подробно разбирается в соответствующих разделах. Можете ещё посмотреть
"Неорганическая химия в 3-х томах" под ред. Третьякова, тоже хорошая книженция.

Я давно подобным не интересовался, поэтому не знаю насколько мои воспоминания релевантны Вашим запросам.
Вообще, метод молекулярных орбиталей мне не очень понятен (по сравнению с методом валентных связей) в той части, что он разрешает и что запрещает.
По-сути он только для двухатомных и малочастичных симметричных систем типа

даёт что-то визуально понятное и осознаваемое, и то, при наличие некоторых расчётов (причём неслабых).
Те же Шрайдер с Эткинсом как ни в чём не бывало рассматривают линейную молекулу

, треугольную молекулу

и какие молекулярные орбитали есть в этих молекулах;
Они важны в качестве переходных и промежуточных состояний в реакции

, поэтому и рассматривают. В качестве молекул эти частицы не существуют (они нестабильны в математическом смысле этого слова -- им не отвечает точка локального минимума на поверхности потенциальной энергии, ППЭ). Первая из этих молекул -- это переходное состояние (т.е. седловая точка), а вторая (в форме равнобедренного треугольника) -- это коническое пересечение двух ППЭ (что можно понять, т.к. это канонический пример действия теоремы Яна-Теллера).
(иллюстрация)
остаётся непонятным, почему водород существует всё-таки в виде
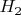
, а не

.
В случае треугольного

это следствие теоремы Яна-Теллера, в случае линейной это понять без расчётов, насколько я знаю, нереально. Ну и то же самое про

, только, если не разводить стандартные махания руками в стиле: "
энергия двух орбиталей в результате взаимодействия понижается, на неё садятся 2 электрона, бла-бла-бла...".