например оксид натрия, реагируя с водой, образует гидроксид, еще и с выделением теплоты.
Как же здесь соблюдается принцип Шателье?
GepidiumДавайте не мешать всё в одну кучу и отделим котлеты от мух.
Во-первых, была заявлена тема о растворимости
солей, а оксид натрия
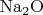
— это не соль.
Во вторых, была заявлена тема о
растворимости солей, а в Вашем примере речь идёт не о растворимости, а о химической реакции. Ведь кристаллогидрат может образоваться тогда, когда молекулы воды способны проникать в ионную решётку вещества. А в упомянутой реакции
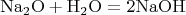
исходные вещества разрушаются, образуя щёлочь. Причём реакция эта протекает очень бурно. Она сильно экзотермичная, мало того, вода, вступающая в такую реакцию при комнатной температуре, может закипеть.
Так что в данном случае ни о какой равновесной системе речи идти не может, и принцип Ле Шателье здесь неприменим.