grisДоброе утро, уважаемый! Я не когда не участвовал ни в каких проектах. Я начал изучение химии потому, что она мне нужна. Вот какая именно часть будет мне нужна - это пока ещё мне неизвестно, т.к. пока что с моим будущим полная неопределённость. Поэтому я должен знать все разделы хотя бы школьной химии и уметь решать все задачи и примеры. Человек я очень забывчивый. Потому мне гуманитарные науки даются с большим трудом. А вот решать задачи - это я очень люблю. Но пока что не все получается решить.
Вчера я нашёл очень интересное видео, где объясняется, что такое электроотрицательность и степень окисления. Это видео:
http://www.youtube.com/watch?v=SM4BxoCoHzk, да плюс Вы мне разъяснили - и так у меня складывается общая картина знаний.
Уже я научился расставлять коэфициенты в уравнениях. Но вот с определением валентности в элементах присутствует непонимание.
Кстати говоря и год назад я пытался повторить химию. Но тогда у меня не было интернета. А были эти книги - Рудзитиса, Фельдмана. По ним конечно, можно учиться. Но вот научиться по ним решать задачи и составлять уравнения химреакций - это фантастика. Потому, что учебники сухо объясняют материал, и расчитаны они и на помощь со стороны учителя и на дополнительное чтение. Сегодня у меня уже более широкие возможности - и я надеюсь, что я дойду до конца вместе с Вами и этим форумом в изучении школьной химии.
Появились у меня новые вопросы. Вот они:
1. Как определить валентности в соединении

? Тут для меня очень сложно - ведь оба элемента с переменными валентностями.
2. Тот же вопрос для соединений

,

,

.
Этот вопрос я упустил - видимо что-то не понял и недочитал. Или невнятно было объяснено в учебниках.
3. Непонятно условие одного из заданий. Вот оно:
Составьте бинарные формулы: а) бор и кислород, б) алюминий и хлор, в) литий и сера.
Я не пойму - что это такое бинарные формулы - какие они?
4. Всегда в соединениях, например

, гидроксильная группа указывается в скобках. Я не пойму зачем нужны эти скобки.
5. написано, что у галогенов температура плавления=

градус, кипения

градуса.
Вопрос - а какое состояние вещества при комнотной температуре и что будет, если галогены внести например в температуру

градусов?
6. Мне непонятно - хлороводород и соляная кислота - это одно и то же вещество с формулой

или нет?
7. Цитирую: "в соединениях кремния с углеродом, кремний проявляет высшую валентность, а углерод низшую".
Вот эта фраза для меня вообще непонятна. Ведь и у углерода и у кремния постоянная валентность
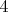
. Как она может быть у одного выше, у другого ниже, если она равна?
Очень жду Ваших ответов.