1. Первая формула не имеет отношения к электрону в поле ядра. Это формула из чисто вспомогательной учебной задачки по квантовой механике - об энергетических уровнях частицы в одномерной потенциальной яме прямоугольной формы с бесконечно высокими стенками. На практике точно таких потенциальных ям не бывает, но зато с такой ямой уравнение Шрёдингера (основное уравнение квантовой механики) решается очень легко.
В этой задаче дно ямы принято за нуль энергии (т.е. начало отсчёта энергии - на дне ямы). Самый нижний доступный частице уровень энергии, первый, получается по этой формуле при

Следующий уровень, второй, более высокий - при

Ну и так далее. Чем больше
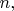
тем выше на шкале энергии лежит уровень энергии. Формула показывает, что в данном примере (т.е. в прямоугольной яме с бесконечно высокими потенциальными стенками) n-ый уровень находится на высоте в

раз большей, чем первый уровень.
2. Вторая формула даёт энергетические уровни электрона (имеющего электрический заряд

в поле ядра c зарядом

При

речь идёт об электроне в атоме водорода. При

речь идёт о единственном электроне в ионе - в однократно ионизованном двухэлектронном атоме. И т.д. Такая формула
строго выводится уже не в лёгонькой учебной, а в очень даже серьёзной, довольно сложной для студентов, задаче из курса квантовой механики.
Если Вы ещё не дошли до серьёзного изучения квантовой механики, то не торопитесь фантазировать. Вам верно ответили: в формуле для энергетических уровней нет явной информации о том, "близко" или "далеко" от ядра находится электрон. Такого рода информацию дают волновые функции электрона, а они бывают разные для уровня энергии с одним и тем же

Чем больше
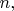
тем больше разных волновых функций. Среди них появляются и такие, из которых следует, что вероятность обнаружить электрон "далеко" от ядра может быть не очень-то и малой. Но есть и такие, которые описывают электронное облако вероятности с максимумом "вблизи" ядра. Все эти разные состояния электрона различаются помимо значений числа
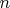
ещё и значениями других так называемых квантовых чисел.
Положение уровней на шкале энергии эта формула описывает вот как. Самый нижний уровень получается при

Этот первый уровень лежит ниже нуля примерно на

Второй уровень, более высокий, получается при

Он тоже находится ниже нуля, но на величину в

раза меньшую, чем первый уровень. И так далее: при каждом

получается уровень, глубина залегания которого под нулём меньше глубины первого уровня в

раз.
Состояния электрона с энергией выше нуля (они не описываются этой формулой) в такой задаче соответствуют полностью ионизованному атому: в этих состояниях отлична от нуля вероятность обнаружить электрон сколь угодно далеко от ядра.



