ihq.plКонечно, неправильно будет записать все эти три уравнения одновременно и считать

всюду одной и той же константой (т.е. независимой от
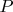
,

,
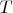
). И даже, если во всех трех случаях обозначить эту константу по разному (скажем,
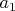
,
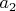
и

), то и тогда легко видеть, что одновременно все эти три величины математически никак не могут быть константами. Т.е. не может быть такого даже гипотетического газа, который подчинялся бы сразу всем трем уравнениям, какие бы константы
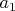
,
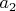
и

мы ни выбрали (кроме нулевых, конечно).
Иногда можно записать уравнения "в другой системе координат".т.е., скажем, в первом уравнении у нас две константы, а во втором - две другие константы. И между этими парами констант есть связь, через которую можно перейти от одних к другим.
Здесь другой случай: есть три выражения, которые просто близки в некоторой области. Но у каждого выражения свои константы, не связанные точно с константами другого. По сути, это три разных газовых закона. Нужно просто выбрать один из них, а не пытаться рассматривать их совместно. Поэтому у них параметр

обозначен одной буквой.



