misha.physicsК вопросу газа, жидкости и твердого тела. Существует уравнение идеального газа (для одного моля молекул):

Это уравнение для газа, молекулы которого - безразмерные массивные точки, которые никак не притягиваются друг к другу. В реальном газе молекулы имеют объем и притягиваются. Но если пространство между молекулами много больше объема самих молекул (малая плотность газа), а средняя скорость молекул гораздо выше "второй космической" (высокая температура, т.е. любые молекулы двигаются друг относительно друга по гиперболическим траекториям), то приближение идеального газа хорошо работает.
Однако, если плотность газа достаточно высокая (объем молекул начинает занимать заметную долю пространства между ними), а температура газа достаточно низкая (средняя скорость меньше "второй космической", траектории молекул становятся "эллиптическими"), то нужно подправлять уравнение идеального газа. Первым шагом в этом направлении будет уравнение Ван-дер-Ваальса:

Здесь просто учитывается, что если объем сосуда равен

, то доступный для движения молекул объем меньше и равен

. А если давление на стенки сосуда равно
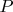
, то давление внутри объема газа больше (из-за притяжения молекул друг к другу) и равно

.
Это уравнение именно для газа. Оно не описывает конденсации/испарения или кристаллизации/плавления, т.е. газ Ван-дер-Ваальса при любых условиях остается однородным, разделения на разные фазы у него никогда не происходит. Однако если такой газ закрыть в сосуде и начинать его сжимать/расширять и нагревать/охлаждать, то он демонстрирует связь между

примерно такую, какую демонстрировал бы реальный газ, который как раз бы конденсировался/испарялся и замерзал/плавился. Т.е. газ Ван-дер Ваальса внешне (судя по

и

) ведет себя так (приблизительно), как будто в нем происходят эти фазовые переходы, хотя на самом деле их нет.
Посмотрите эту тему, это может быть полезно. Это самое простое уравнение, которое с единых позиций описывает некоторые свойства газа, жидкости и твердого тела.



