Охладит. Стремительно или нет - вопрос относительный. Установится какое-то новое состояние равновесия скорее всего при меньшей температуре.
А если кусочек энергии, который выделился в экзотермической реакции останется в системе, то изменение энтальпии реагентов и продуктов реакции будет равн нулю? Ведь эта энергия, которая выделилась, она увеличит потом эту разницу энтальпий, которая показывала, что реакция экзотермическая (

).
Про эндотермическую реакцию я прочитал в учебнике, что это реакция всегда идет с притоком извне энергии.
Munin мне писал, что здесь не при чем среда и тому подобное, что окружает реакцию. Потом мне здесь привели примеры про растворение соли в воде и понижение тем самым температуры раствора, вопрос так и не исчерпан, если систему вода и соль изолировать, то в такой реакции, раз она эндотермическая

и я не могу допереть, если реакция поглощает тепло сама у себя в изолированной системе, то откуда излишек энергии, если взять она ее не может условно говоря из окружающей среды?
Я снова запутался, то нужно думать о среде, то не нужно, если реакция сама себя может охладить, то зачем нужна среда, но тогда откуда излишек энергии, конкретно в
ЭНДОтермической реакции. Как вообще реакция может сама себя охладить и при этом привнести тепловую энергию (math]

[/math]?).
Из этого всего я делаю вывод опять же, можно ли назвать "Поглощением" то, что теплота переходит от более нагретого - к менее нагретому, о менее нагретом можно сказать, что "Поглощает" тепло в таком случае от более нагретого? Как реакция воды с солью сначала забрала тепло у самой себя, а потом забрала тепло у того, что ее окружает (то есть дважды взяла откуда-то прирост энтальпии). Прирост энтальпии ведь должен сопровождаться повышением кинетической энергии, а следовательно температуры, а тут все наоборот как-то (
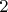
-ой прирост понятен вследствие теплообмена, но вот
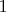
-ый нет, который вследствие охлаждения самого себя).



