Судя по "мутным" вопросам:
Выходит, что зависит от пути перехода из состояния
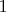
к состоянию
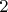
, а не определяется конечными положениями состояний?
хочет все таки понять глубинную взаимосвязь между формулами:

при

Для получения этого понимания предлагаю
Vladimirkey подумать и решить следующую задачу:
Пусть мы переводим идеальный газ из состояния 1 в состояние 2 по произвольному пути.
Определить приращение энтальпии в этом процессе перехода из 1 в 2.
Рассмотреть два варианта:
1) в точках 1 и 2 одинаковое давление.
2) в точках 1 и 2 разное давление.
Для вычисления приращения энтальпии между состояниями 1 и 2 мы можем проводить этот идеальный газ по произвольному пути (состоящему из изобар, изотерм, изохор, адиабат и т. п.) а также измерять подвод/отвод теплоты в этих процессах.