В общем, в учебнике сказано, что такие соединения называются гипервалентными. Из примеров до конца разобран только

(§ 3.12б, Приложение 4).
Непосредственно молекулярных орбиталей не нарисовано, но дано словесное описание и картинки, позволяющие понять, о чём речь. Молекула

- октаэдр, в центре атом серы, а по вершинам - фтора. В образовании молекулярных орбиталей участвуют

и

-орбитали серы, и

-орбитали фтора, по одному от каждого атома, те, которые направлены к атому серы (то есть, по осям октаэдра). Остальные орбитали фтора заполнены полностью, и расположены от серы (и других фторов) далеко, и в гибридизации не участвуют.
Схемы образования молекулярных орбиталей:
Здесь для каждой молекулярной орбитали, в её образовании участвуют те атомные, которые пересекаются с ней, причём "сумма пересечений" не нулевая. Поясню:
- в образовании

участвуют:
-  поскольку она симметричный шарик, и здесь пересекается с шестью белыми шариками;
поскольку она симметричный шарик, и здесь пересекается с шестью белыми шариками;
-  - каждая из них пересекается с одним белым шариком, причём только одной своей половиной (долей) - внутренней;
- каждая из них пересекается с одним белым шариком, причём только одной своей половиной (долей) - внутренней;
- не участвуют  поскольку они антисимметричные гантельки, и если одна половинка гантельки
поскольку они антисимметричные гантельки, и если одна половинка гантельки  пересекается с одним белым шариком, то другая половинка гантельки
пересекается с одним белым шариком, то другая половинка гантельки  - с другим белым шариком, в сумме дают ноль.
- с другим белым шариком, в сумме дают ноль.
- в образовании

номер 1 участвуют:
-  участвуют;
участвуют;
- не участвует  поскольку она симметричный шарик, а здесь пересекается с двумя большими белыми шариками, и четырьмя чёрными - подразумевается, что сумма ноль;
поскольку она симметричный шарик, а здесь пересекается с двумя большими белыми шариками, и четырьмя чёрными - подразумевается, что сумма ноль;
- не участвуют 
- в образовании

номер 2 участвуют:
-  участвуют;
участвуют;
- не участвует  поскольку она симметричный шарик, а здесь пересекается с двумя белыми и двумя чёрными - сумма ноль;
поскольку она симметричный шарик, а здесь пересекается с двумя белыми и двумя чёрными - сумма ноль;
- не участвуют 
- в образовании

участвуют:
-  участвуют, поскольку они гантельки, и одна половинка гантельки
участвуют, поскольку они гантельки, и одна половинка гантельки  пересекается с белым шариком, а другая половинка гантельки
пересекается с белым шариком, а другая половинка гантельки  - с чёрным шариком,
- с чёрным шариком,  и в сумме их вклады складываются;
и в сумме их вклады складываются;
-  участвуют;
участвуют;
- не участвует  поскольку она симметричный шарик, а здесь пересекается с белым и чёрным - сумма ноль.
поскольку она симметричный шарик, а здесь пересекается с белым и чёрным - сумма ноль.
К чему это приводит? Вот схема уровней энергии получающихся молекулярных орбиталей:
Здесь используются упрощённые обозначения

У фтора все уровни - это

от шести атомов - шесть уровней, заполненных шестью электронами. Они изначально расщеплены (слабо), поскольку даже без атома серы, эти

-электроны немного взаимодействуют друг с другом.
О чём эта схема говорит? О том, что сера не даёт вклада в гибридизованные орбитали

!!! Атомные орбитали серы не дают вклада в эти молекулярные орбитали, а расходятся по орбиталям

Уровень энергии орбиталей

не сдвигается вообще, он как был у фторов без серы, так и остался. То есть, эти орбитали не участвуют в химической связи фторов с серой - они только касаются отношений фторов между собой. Сера связана со фторами только через орбитали

- своей орбиталью

- и через
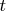
- своими орбиталями

Куда какие идут электроны? Понятное дело, что электроны все тождественны, но здесь мы имеем у фторов полностью заполненную

как до гибридизации, так и после, и её уровень не сдвигается, то есть ведёт себя аналогично электронам на внутренних оболочках атомов, и мы можем сказать, что они остаются на этом уровне. Значит, у серы её 6 электронов складываются с 2 оставшимися электронами фтора, и всё это заполняет связывающие орбитали

Снова выполняется пресловутое "правило октета"!
А вот метод валентных связей в данном случае рисует неадекватную картину: он изображает, что атом серы взаимодействует с 12 электронами, а не с 8, как на самом деле.
(На более глубоком уровне, можно сказать, что

-электроны атомов фтора участвуют в образовании делокализованной связи, имеющей те же типы симметрии, что и электронные орбитали водородоподобного атома: орбиталь

подобна
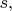
орбитали
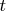
подобны

а орбитали

подобны

и

В этом смысле,

по сложности ближе к молекуле бензола, чем к простым школьным соединениям. При этом, не все такие делокализованные орбитали образуют связи с серой, а только 4 из них - на что вполне хватает её двух одиноких электронов и двух неподелённых пар.)
-- 03.07.2017 16:36:50 --Ну или написал бы хотя бы даже так: с точки зрения правила октета существование многих соединений объяснить затруднительно, нужна более сложная теория.
Тогда бы у мыслящих школьников не появлялось чувство, что их обманывают.
А то вначале приводит это правило как некую истину, а потом, при рассмотрении конкретных соединений, напрочь про него забывает и не комментирует, хотя обнаружить неувязки школьникам вполне реально.
+1.