Приношу свои извинения. Данную тему лучше переместить в "Дискуссионные темы". Для ответа напоследок вынужден процитировать относительно роли законов электролиза в признании элементарного заряда (т.к. нельзя форумчан часто отсылать к первоисточнику).
Предположение, что закон Фарадея, вместе с гипотезой о существовании атомов, приводит к заключению, что и электричество, по крайней мере, при электролизе, должно состоять из дискретных элементарных зарядов, было впервые заявлено Стонеем и Гельмгольцем (в речи, посвященной памяти Фарадея 5 апреля 1881 г.). Проанализируем доказательства существования дискретности электричества, приводимые Гельмгольцем, и другими физиками, разбив их на тезисы [Шпольский Атомная физика, стр.11].
Тезис "А": "Из законов электролиза следует, что если пропускать одно и то же количество электричества через различные электролиты, то количество веществ, выделяемых в растворах одновалентных ионов, будет пропорционально атомным весам ионов. Если это количество электричества как раз таково, что оно выделяет один г-ат определенных ионов, то в любом другом электролите, содержащем одновалентные ионы, оно выделит тоже один г-ат ионов".
Тезис Б: "Так как электрический ток в электролите обусловлен движением ионов, то можно сформулировать установленный факт, утверждая, что один г-ат одновалентных ионов, содержащий одинаковое количество частиц, равное числу Авогадро:

, несет с собою всегда одно и тоже количество электричества

Кл, вне зависимости от природы этих ионов. Наиболее вероятно, что весь электрический заряд распределен равномерно по всем частицам, и заряд, переносимый одним ионом, будет иметь совершенно определенную величину, равную

; заряд, переносимый каждым двухвалентным ионом, будет

; z-валентным ионом:

. Т. е. различные ионы могут нести на себе заряды, кратные

: равные

,

, …,

".
Анализ тезиса "А" начнем с того, что "количество веществ, выделяемых в растворах одновалентных ионов, будет пропорционально атомным весам ионов" тогда, когда в разных химических реакциях превращаются одинаковые числа
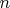
атомов или молекул, ибо масса любых продуктов реакции

, где
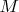
— масса молекулы полученного вещества. Так как в законах электролиза количество электричества, равное числу Фарадея, жестко привязано к превращению числа частиц

, то массы превращенных веществ оказываются пропорциональными и атомным весам ионов, и количеству электричества.
Помимо этого, при анализе тезиса "А" следует исходить из факта, что количество электричества, которым оперируют в электролизе, через электролит не "пропускается", а подводится от внешнего источника тока к электродам для создания и поддержания на них требуемой для электролиза разности потенциалов

. К тому же на электролиз затрачивается не количество электричества, а электрическая энергия. На первые акты химического превращения израсходуется электрическая энергия:

, и без подключенного внешнего источника тока напряжение на электродах электролизера уменьшится до

. Включение вновь источника тока, вызовет, в результате возникшей разности потенциалов (

) между ним и электродами электролизера, протекание электрического тока
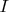
в течение времени

, пока напряжение на электродах не восстановится до

(или до значения, при котором возможен электролиз). Это количество электричества

, восстанавливающее напряжение на электродах, пропорционально количеству превращенного вещества, ибо протекание тока
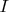
вызвано химическими процессами, идущими в течение времени

. Т. к. химические реакции идут согласно закону кратных отношений, то и количество электричества будет пропорционально эквивалентам превращенных веществ. Энергия в электрохимических процессах подводится (отводится) электрическим током, который измеряется во внешней цепи, а не в электролите.
Для выяснения вопроса о переносе электрического тока ионами рассмотрим обобщенный закон Фарадея:

где
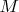
— молекулярная масса вещества, участвующего в электролизе;

— количество электричества, которое подводится к электродам в процессе электролиза;
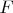
— постоянная Фарадея;

— эквивалентное число (или число электронов).
Из тезиса "Б" следует, что число ионов
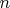
, перешедших за время
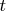
в электролит с электрода (или обратно) и несущих общий электрический заряд:

, пропорционально количеству превращающихся на электроде частиц
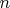
за это время. Ток ионов:

, где

— зарядовое число ионов, движущихся к электроду (или от него). Если

в знаменателе формулы обобщенного закона Фарадея (1) принять, как это принято, за количество электронов, участвующих в реакции, то

в числителе и

в знаменателе оказываются равными по величине.
Подставляя в (1)

, с учетом равенства

, после сокращений, получим формулу закона Фарадея вовсе без участия электрических зарядов:

где:

— мольная доля превращенного вещества с молекулярной массой
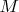
;

— число Авогадро. Масса
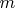
, прореагировавшего на электроде вещества, пропорциональна произведению мольной доли

на молекулярную массу вещества
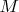
. От количества электричества, фигурировавшего в (1), в формуле (2) остается только количество частиц
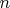
, участвующих в реакции (вне зависимости от их заряда). Согласно (2), при участии в электродных реакциях одинаковых количеств частиц
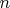
разных веществ, получим массы веществ, пропорциональные молекулярным массам этих веществ. Об этом было сказано при рассмотрении тезиса "А" и говорится в законах Фарадея.
В тезисе "Б" также утверждается, что различные ионы могут нести на себе заряды, кратные

. Считается, что ток электронов при электролизе идет не в электролите от электрода к электроду, а от одной клеммы внешнего источника тока к одному электроду, и от другого электрода ко второй клемме источника тока. То есть измеряемое количество электричества, входящее в законы электролиза, подводится от внешнего источника тока к электродам, на которых протекают химические реакции, для восстановления напряжения, а не переносится "на ионах" в электролите.
Движение ионов к электродам (от них) осуществляется в результате диффузии реагентов и продуктов реакций, за счет образующихся градиентов концентраций у электродов и в объеме электролита. Скорость перемещения ионов диффузией (при прочих равных условиях) определяется скоростью реакции, которая зависит от разности потенциалов на электродах. Диффузия продуктов электролитических реакций от электродов в объем, а реагентов из объема электролита (к электродам) не нуждается в электрических силах. Ионы диффундируют, получая энергию на перемещение из окружающей среды, от электродов (всегда отличных, по сравнению с электролитами, проводников тепла), от теплового эффекта реакции. Подвод (отвод) энергии для электродных реакций, осуществляемый электронами к электродам (от них), а перемещение веществ — ионами, требуется только после акта химического взаимодействия.
Как видим, законы электролиза, являющиеся базой для ввода в науку дискретной структуры электричества, описываются без привлечения элементарных электрических зарядов.
Дискретность электронов в атоме (или молекуле), заложенная в модель строения атома, наиболее явно выражена в понятии многократно заряженного иона как частицы, имеющей недостаток (или избыток) сразу нескольких электронов. Сущность МЗИ в электролитах объясняется валентностью элемента, его возможностью "одновременно" взаимодействовать с несколькими атомами (группами атомов). Это сказывается на потребностях в энергии на электролиз, на скорости диффузии ионов к электродам (от них) и на изменении концентраций возле электродов, а, следовательно, — на силе электрического тока, восстанавливающего напряжение на электродах. Например, в случае выделения на электроде из электролита пятивалентного металла (или растворения электрода из этого металла) "одновременно" высвобождаются (связываются) пять анионов, тогда как при выделении одновалентного элемента концентрация анионов возрастет только на один анион.
Отсутствие в химии надежных доказательств существования МЗИ, а также, исходя из того, что главным доказательством дискретности электронов в атоме считается существование МЗИ в плазме, вытекает необходимость рассмотрения природы таких ионов.