Изучая книгу: К. Хуанг «Статистическая механика», которую мне порекомендовали на этом форуме, у меня возник вопрос, вынесенный в заголовок темы.
Привожу, для удобства, цитаты из этой книги, которые нужно сопоставить между собой.
«и.
Теплота – энергия, поглощаемая однородной системой при увеличении температуры, если при этом работа не производится. Если

- малое количество тепла, поглощённое системой, а

- обусловленное этим малое изменение температуры, то
теплоёмкость системы 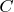
определяется соотношением

Теплоёмкость зависит от свойств системы и является одной из её характеристик. Из опыта известно, что при одной и той же разности температур

величина

может быть различной при разных способах нагревания системы. Следовательно, теплоёмкость зависит от способа нагревания. Обычно рассматривают теплоёмкости

и

, соответствующие нагреванию при постоянном объёме и давлении. Теплоёмкость единицы массы или грамм-молекулы вещества называют
удельной теплоёмкостью .»
«”Первый закон термодинамики”
Пусть

- полное количество тепла, поглощённое системой при
произвольном термодинамическом процессе, а

-- полная работа, произведённая при этом системой. Первый закон термодинамики гласит, что величина

, определяемая равенством

одинакова для всех процессов, в результате которых система переходит из данного начального состояния в данное конечное.
Это сразу позволяет определить функцию состояния
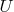
, называемую внутренней энергией».
«Рассмотрим некоторые приложения первого закона термодинамики.
а.
Обсуждение опыта джоуля по свободному расширению газа. В этом опыте исследуется свободное расширение идеального газа в пустоту. Начальное и конечное состояния изображены на фиг. 3.
Результат опыта:
 Следствия опыта
Следствия опыта. Поскольку газ не совершает работы над внешней средой, то

. Изменение температуры равно нулю:


, следовательно, и

. Таким образом, согласно первому закону термодинамики, изменение внутренней энергии газа

. Иными словами, два состояния идеального газа, характеризующиеся одинаковой температурой, но разным объёмом, имеют одну и ту же внутреннюю энергию. Поскольку температуру и объём можно выбрать в качестве независимых переменных и поскольку внутренняя энергия
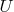
является функцией состояния, мы приходим к выводу, что для идеального газа внутренняя энергия
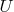
является функцией только температуры».
"б.
Внутренняя энергия идеального газа. Поскольку
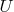
зависит только от
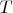
, то из (1.8) получаем

Предполагая, что теплоёмкость

не зависит от температуры, находим

Произвольную аддитивную постоянную можно положить равной нулю".
Теперь мои сомнения.
Я не сомневаюсь в первом законе термодинамики, его смысл мне понятен. Из первого закона непосредственно следует: если газ не совершает работы и над газом не совершается работа, то приращение внутренней энергии газа равно приращению теплоты.
Иными словами, внутренняя энергия газа есть функция теплоты.
Здесь же делается вывод, что внутренняя энергия газа есть функция только температуры.
Физический смысл теплоты мне понятен. Теплота газа пропорциональна средней кинетической энергии движения всех частиц газа и измеряется в джоулях.
Физический смысл понятия температуры мне не понятен, но температура связана с теплотой через теплоёмкость. Вот если бы теплоёмкость была какой-то стабильной константой, различной для различных веществ, то температура была бы пропорциональна теплоте, где теплоёмкость
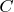
выступала бы как коэффициент пропорциональности. Тогда можно было бы также сказать, что внутренняя энергия газа является функцией температуры. Но, теплоёмкость всё же зависит от температуры, а ещё она зависит от «способа нагрева газа». Если газ нагревать при постоянном объёме или при постоянном давлении, то теплоёмкости одного и того же газа будут различны.
"Теплоёмкость зависит от свойств системы и является одной из её характеристик."
Сама теплоёмкость является функцией «непонятно чего».