Простите мою наивность, по химии последний раз учебник в школе открывала, но какое-то странное уравнение

(тут и
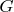
и

-- это из-за того, что в реакции есть и твердая и газовая фазы ?). У меня не задворках памяти уравнение такое (и с ним все понятно)

, где
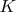
-- константа равновесия, она же -- дробь, какую тут с третьей попытки записали.