Это подразумевались химические формулы
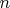
-атомной молекулы и
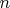
отдельных атомов. В конце концов, неудачные,
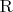
- произвольный радикал, а не именно атом.
Наверное, надо просто сравнить давления двух разных газов, отличающихся как одно- и двух-атомный, а не представлять себе реального процесса перехода между ними. О реалистичности такого перехода авторы задачи не задумывались. Наверное, в каких-то условиях такое можно реализовать, если исходный газ был не в состоянии термодинамического равновесия... но подразумевалось вовсе не это.
Так что, у вас есть просто два газа: одноатомный и двухатомный, с массами молекул, отличающимися вдвое (такое бывает, например, для трития и гелия-3), и в одном случае рассматривается чистый двухатомный газ, а во втором смесь 1:1 по массе, совпадают масса, объём и температура, надо сравнить давления.