Добрый день. Имеется твердый неорганический катионит, который извлекает определенного типа катионы из раствора. Изотерма сорбции (ионного обмена) хорошо аппроксимируется модельным уравнением Ленгмюра- Фрейндлиха:

Где

– удельная равновесная сорбция, ммоль/г;

– полная обменная ёмкость ионообменника, ммоль/г;

- равновесная концентрация ионов цезия в растворе, ммоль/л;
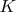
- константа из уравнения Ленгмюра;
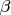
– эмпирический коэффициент, учитывающий отклонение от уравнения Ленгмюра, вследствие неоднородности ионообменных центров поверхности и взаимодействия ионов на поверхности ионообменника между собой,

.
Величины, количественно характеризующие эффективность сорбции:
Коэффициент распределения:

Коэффициент селективности (Амфлетт «Неорганические иониты», стр. 11-14) определяет глубину протекания ионообменного процесса на твердом ионообменнике, с участием извлекаемого иона, и фактически является константой равновесия данного процесса. Так, для процесса:


Начальная концентрация иона

:

С учетом приведенных соотношений, выражение для коэффициента селективности принимает вид:

(
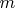
- масса ионообменника;

- объём раствора)
Поскольку мы имеем дело с очень разбавленными растворами (порядка не более 0,4 ммоль/л) активность ионов в растворе полагается равной их концентрации. Сам вопрос звучит так: Почему коэффициент селективности (суть константа равновесия), согласно выражению (6) оказывается зависящей от равновесной концентрации извлекаемого иона, хотя должна быть постоянной величиной? Попытка разобраться самостоятельно: Похоже, что в выражение для коэффициента селективности нужно вводить коэффициенты активности для ионов связанных с твердой фазой,
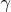
. Т.е.:

Или, согласно (6):

С учетом того, что
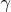
должна быть безразмерной величиной, а коэффициент селективности иметь постоянное значение:

и

И тогда:

Допустим эти заключения верны. Тогда при малых равновесных концентрациях иона

,

, концентрация его в твердой фазе должна стремиться к нулю, а коэффициент активности

Тогда из (9)

.
И наоборот при

, удельная сорбция иона

выходит на полочку, соответствующую

, и не меняется в зависимости от равновесной концентрации

. А значит

при этом условии. Правая часть выражения (9) также стремится к

.

, поскольку концентрация в твердой фазе

стремится к нулю, И, таким образом, не противоречит условию (9). Поэтому заключительный вопрос звучит так. Правильно ли предположение о необходимости введения коэффициентов активности ионов в твердой фазе, в выражение для коэффициента селективности? И можно ли из выражения (9) достать аналитический вид для коэффициентов активности ионов в твердой фазе?