Доброе утро.
Весенне-летнее обострение, по-видимому, продолжается, и новый поток бреда несётся из моей головы на Форум. На этот раз связано всё с концепциями гидрофильности и гидрофобности, и прошу за это прощения.
В результате очередной бредогенерации, мне причудилось, что упрощённая
модель Флори-Хаггинса для растворов полимеров объясняет понятие гидрофильности и гидрофобности в следующем контексте. Допустим, у нас есть жидкость "A" и есть жидкость "B". Мы их взболтали, и попытались смешать (вопреки заветам
агента 007). И вот вопрос: выгодно ли термодинамически образование раствора "A+B", или жидкостям захочется расслоиться обратно на две не смешанные фазы (как, например, если это вода и масло). Вот иллюстрация:

Чтобы оценить выгодность сего факта смешения жидкостей, будем считать, что объём у нас не меняется, поскольку молекулы каждой из жидкостей, имеют фиксированный объём, и никаких коллегативных эффектов у нас нету. Т.е. если у нас было

литров жижи "A" и

литров жижи "B", то смешав их, мы получим новую жижу "A+B" объёмом

. Из этого мы делаем два вывода. Первый: мы будем смотреть на свободную энергию смешивания Гельмгольца

,
где
U -- внутренняя энергия, а
S -- энтропия. Ну а второе -- это то, что нам нужны только количества молекул каждого типа:

и

, или даже тупо их концентрации:

,

, где

-- это полное число всех молекул. Очевидно,

.
Смешанная система "A+B" будет более термодинамически выгодной для данной температуры и объёма, если свободная энергия будет отрицательной (

).
Собственно, для начала выпишем
энтропию смешения, т.к. она самая простая:

где

-- это константа Больцмана. Поскольку

, то оба логарифма отрицательны, и значит сама энтропия -- положительная величина. Что логично, если мы смешали две разные жижи, то из-за рандомного размещения частиц мы увеличили число микросостояний. Т.е. с энтропийной точки зрения, смешение всегда выгодно, т.к. член свободной энергии

.
(вывод энтропии смешения)
Стартуем с уравнения Больцмана

, где
W -- число состояний. Для нас оно равно

. Используя формулу Стирлинга

, мы получаем

. Подставляя же

и

, мы получаем искомое выражение.
Для
внутренней энергии смешения немножечко всё хитрее. Для неё мы воспользуемся формулой:

где
Q>0 -- это коэффициент, включающий в себя всякие координационные числа, множитель

-- это количество новообразованных контактов между молекулами A...B по сравнению с изначальной смесью всяких A...A и B...B, а

-- это выигрыш в энергии от образования новых контактов A...B по сравнению со старыми A...A и B...B. Собственно, этот множитель нас и интересует. Будем считать, что у нас нет никакой диссоциации, никаких ионов: какие молекулы загрузили, такими они и остаются. Значит у нас есть несколько основных типов межмолекулярных взаимодействий:
- Если обе молекулы i и j полярные (имеют постоянный дипольный момент
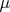 ), то они будут взаимодействовать через диполь-дипольное взаимодействие, пропорциональное
), то они будут взаимодействовать через диполь-дипольное взаимодействие, пропорциональное  , где R -- расстояние между двумя молекулами. Но поскольку в жидкости (если не думать о всяких водородных связях) у нас все молекулы ориентированы рандомно, то мы можем использовать силу Кеезома:
, где R -- расстояние между двумя молекулами. Но поскольку в жидкости (если не думать о всяких водородных связях) у нас все молекулы ориентированы рандомно, то мы можем использовать силу Кеезома:

где  -- постоянная, включающая в себя всякие факторы, чтобы сделать нужную размерность.
-- постоянная, включающая в себя всякие факторы, чтобы сделать нужную размерность. - Если одна молекула (i) полярна, а вторая (j) -- неполярна (без дипольного момента), то они будут взаимодействовать через индукционное взаимодействие, когда полярная молекула будет наводить в неполярной удобный для взаимодействия дипольный момент, и с этим моментом взаимодействовать. Закон взаимодействия в этом случае имеет вид:

где  -- опять постоянная всяких размерностей, а
-- опять постоянная всяких размерностей, а  -- поляризуемость нашей неполярной молекулы.
-- поляризуемость нашей неполярной молекулы. - Ну и две неполярные молекулы взаимодействуют через дисперсионное взаимодействие, которое возникает (в классической картине) как взаимодействие мгновенных случайно возникающих диполей. Формула у нас вновь имеет вид
 .
.

Все эти взаимодействия у нас описываются уравнениями типа

где

-- некая постоянная,

-- это способность молекулы
i участвовать в соответствующем взаимодействии, а
R -- расстояние между молекулами, которое, грубо говоря, завязано на размер этих молекул:

. Заметим, что все эти взаимодействия у нас притягивающие (т.е. молекулам выгодно быть ближе друг к другу), а отталкивание из-за обменного взаимодействия, вступающего на очень коротких расстояниях, и будет давать размеры

и

каждой из молекул.
Чтобы найти

, мы можем рассмотреть следующую псевдореакцию:

т.е. разделив одну пару димеров A...A и одну пару димеров B...B, мы можем организовать два димера A...B. Изменение внутренней энергии этой реакции равно соответствующей разнице внутренних энергий продуктов/реагентов

(эти внутренние энергии даются значениями энергий взаимодействий выше),
что в пересчёте на одну новую пару связей A...B, мы и получим

Заменяя переменные
q на

и

, мы можем переписать наше выражение для

как

При схожих размерах молекул (

) и даже для разных типов взаимодействий A...A, B...B и A...B (например, если это диполь-дипольное, дисперсионное и индукционное, соответственно), мы можем ожидать, что

, из чего мы получаем

Т.е. мы получаем, что из-за смешивания разных типов молекул, у нас всегда ожидаем проигрыш во внутренней энергии.
Иными словами, у нас есть два противоположных фактора, определяющих термодинамическую (не)выгодность образования раствора "A+B" в нашей свободной энергии:
- энтропийный
 , который всегда не положительный, и при этом ещё растёт по модулю при увеличении температуры,
, который всегда не положительный, и при этом ещё растёт по модулю при увеличении температуры,
- внутриэнергетический
 , который у нас всегда неотрицательный, и не зависит, или даже убывает (для силы Кеезома) при увеличении температуры.
, который у нас всегда неотрицательный, и не зависит, или даже убывает (для силы Кеезома) при увеличении температуры.
В зависимости от соотношения количеств разных частиц, от их типа, размера, и от температуры, выигрывать будет то один, то другой из этих факторов. Но в целом, для выгодности смешивания при фиксированных концентрациях разных частиц и температуре, нам нужно чтобы

был как можно более близким к нулю, т.е. энергии взаимодействия в разных жидкостях должны быть сопоставимы (

). Если же типы взаимодействий совсем разные, то для не очень высоких температур, как ни старайся, смешивание во всех возможных соотношениях концетраций может быть очень невыгодным.
Отсюда, полярные молекулы (например, вода и метанол) будут хорошо смешиваться друг с другом, и неполярные (бензол и масло) тоже будут смешиваться друг с другом. А вот полярные с неполярными (вода и масло) будут недовольны такому соседству в смеси, и предпочтут разделиться на две фазы.
Собственно, у меня есть несколько проблем:
Поэтому если кто-то видит тут косяк, или знает, где такое объяснение найти, можете пожалуйста поделиться инфой?
