Доброго всем времени суток. Помогите пожалуйста решить задачу.
1. Какой ток
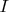
должен проходить через электролит, чтобы за

мин. разлагался 1 г. воды?
2. Каков объем

выделившегося при этом гремучего газа (при нормальных условиях)?
1. по 2-му закону Фарадея масса, выделившегося вещества на электроде, в данном случае водорода
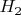
на катоде:

. Отсюда:

.
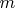
нахожу из условия, что при разложении одного моля воды (

г) выделяется 2г водорода, соответственно при разложении 1г воды выделится

г водорода. Валентность водорода
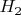
как иона, отделившегося от молекулы воды:
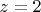
,

г. Все ли верно?
2. Как в данном случае понимать гремучий газ? Это смесь
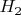
в воздухе? Не понимаю массу
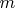
какой смеси газов подставлять в Менделеева-Клайперона?