Молекулы идеального газа не сталкиваются.
Смотря в каком смысле. Они, конечно, сталкиваются достаточно редко, чтобы не нарушать уравнение состояния идеального газа. Но при этом достаточно часто, чтобы установилось равновесное распределение, и длина свободного пробега была пренебрежимо мала по сравнению с рассматриваемым объёмом газа. Это несколько противоречивые требования, и пытаясь дойти до этих границ, мы вынуждены отказываться от модели идеального газа: увеличивая плотность, мы приходим к неидеальному газу, например, к ван-дер-ваальсову, а уменьшая плотность - к бесстолкновительному газу, с совсем немаксвелловским распределением.
Теперь про главное. Если молекулы - шары, то они имеют собственный объём. Что случится с нашим pV=nRT, когда мы попытаемся сжать газ до объёма, меньшего, чем этот собственный?
Если молекулы - шары с ненулевым собственным объёмом, то верно не уравнение состояния идеального газа

(в русской литературе больше принято

- количество вещества, а
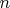
- концентрация), а как минимум уравнение состояния газа Ван-дер-Ваальса

где постоянная
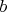
- объём молекул, а

отвечает за энергию притяжения молекул, и может быть взята нулём.