Спасибо за разные способы. Мне очень интересно их смотреть даже если они в данных случаях нерациональны, ведь это все та же физика просто с разных сторон.
Pphantom, ваши объяснения с уравнением состояния газа понял. При этом независимо нужно знать, что средняя скорость пропорциональна корню из температуры.
sergey zhukov, пробовал разобраться со сжатием и растяжением распределения, на запутался, похожим приемом ещё не пользовался вроде. Я так понимаю, в конечном счёте мы перемасштабирование скоростей перевели в перемасштабирование температуры и сохранили тот же вид распределения. Но я не понял это математически. Выходит, что

здесь обозначает другое, чем я привык, т.е. это не просто замена аргумента
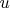
в функции

на

, иначе в самом начале не было бы множителя

перед

. А если он там должен быть, то откуда следует первое равенство? И я не до конца понял, что вы понимаете под растяжением и сжатием. Мне подумалось, что если у нас есть функция

, то мы можем изменить масштаб на осях
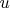
и
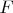
в

раз и у нас форма кривой останется прежней, но тогда нужно говорить об сжатии и сжатии (растяжении и растяжении). Что-то я не понял.