Здравствуйте!
Предлагаю обсудить зависимость энтропии не от объёма, занимаемого одной частицей, а от длины свободного пробега. Ведь именно длина свободного пробега определяет термодинамические свойства.
Вот моё решение классического парадокса Гиббса.
Описание в Википедии:
https://ru.wikipedia.org/wiki/%D0%9F%D0 ... 1%81%D0%B0«Обычно выход из тупика там же, где и вход» - народная мудрость :)
Энтропия идеального газа выражается формулой:
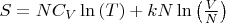
(1),
где
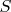
– энтропия,
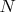
— количество частиц,

- теплоёмкость при постоянном объёме,
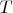
– температура,
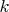
— постоянная Больцмана,

– объём.
Рассматривают два одинаковых объёма газов с одинаковыми
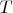
и
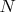
, между которыми перегородка. Перегородку убирают. В первом случае смешивают два одинаковых газа; во втором - два почти не отличающихся различных газа. Получаются энтропии с разницей в

(2) .
В экспериментах никакой разницы нет!
Выход из этого тупика будем искать там же, где и вход. А именно, в формуле (1).
Заметим, что длина свободного пробега частиц равна:

(3),
где
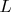
— длина свободного пробега частиц,
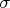
— площадь поперечного сечения одной частицы.
Тогда формула (1) преобразуется к виду:

(4).
При смешении что одинаковых газов, что почти похожих, длина свободного пробега частиц (
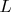
) не меняется. Поэтому и энтропии этих газов ведут себя одинаково.
Что решает классический парадокс Гиббса.
Всем наилучших пожеланий!
Счастья и здоровья!