Значит где-то ошиблись. Ответ должен быть одинаковый что для "моей" замены, что для "Вашей".
Так ответ у нас и одинаковый

.
-- 06.05.2015, 19:23 -- А вы телесный брали, теперь понятно, почему у меня не получалось.
Исходная формула у Вас была написана для трехмерного распределения (хороший контрольный вопрос - почему?)
Изначально я записал распределение по
векторам скоростей двух молекул. Ясное дело, что трехмерное. А когда мы хотим получить распределение по модулю, мы переходим в сферические координаты, где полярный угол
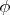
и угол
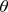
учитывают всевозможные положения векторов. Я не понимаю, зачем нужен телесный угол, если есть углы
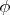
и
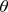
. Оттого и не вводил его. Я и не совсем понимаю, как он вводится.



