Намедни проводил эксперимент по электролизу слабого раствора серной кислоты. Разность потенциалов, подведённая к платиновым электродам, была 29,9 вольт. Целью эксперимента было найти постоянную Фарадея, подсчитывая совершённую током работу по электролизу и количество выделившегося водорода согласно формуле

где
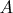
— работа тока,
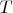
— температура водорода,
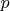
— давление водорода,
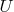
— напряжение на электродах,

— объём водорода.
Однако получилось, что почти все записанные значения
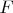
занижены настолько, что даже не попадают в коридор погрешностей. Не могу понять, что же было тут не так. Перебрав самые разные причины относительно входящих в уравнение компонетов, я не пришёл ни к какой мысли "почему", ибо наиболее вероятные причины (где-то не плотно закрыл кран, где-то теряется работа тока по пути, где-то падение напряжения существенное, ...) дают обратный эффект, а именно завышение
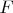
.
Я пока не особо понимаю, какая нужна дополнительная информация, поэтому спрашивайте. Установка учебная, см. рис. 1. Для измерения работы тока использовался ваттметр, тоже учебный.
 -- 22.09.2016, 00:06 --
-- 22.09.2016, 00:06 --Добавлю ещё, что действительно наблюдалось то, что выделено было кислорода примерно вполовину меньше, чем водорода. Но последнего получилось по расчётам "слишком много", а побочные процессы на
катоде с выделением газов мне неизвестны.