Добрый день! Не справился с задачкой из школьного курса. Хотя задачка простая.

Задача:
Найти молекулярную формулу алкина, если при его сгорании образуется углекислый газ объёмом 20,16 л и вода массой 13,5 грамм.
Собственно, загвоздка в том, что почти ничего не известно об исходном веществе, помимо того, что это - алкин, т. е. имеет формулу

. Но нет ни массы, ни плотности по другому веществу.
1) Сперва пытался решить элементарно. Определил количество молей углекислого газа:

и воды:

Отсюда количество вещества для углерода:

и водорода:

Простейшая формула данного алкина -

Надеюсь, никого не оскорбит такая запись, это ведь простейшая, а не истинная формула вещества. :)
С самОй простейшей формулой ничего сделать не смог, а для нахождения истинной формулы нужна истинная молярная масса алкина, которую, в свою очередь, я не могу найти.
2) Решил воспользоваться законом сохранения массы веществ для нахождения массы алкина. Очевидно, что масса алкина равна массе углерода и водорода. Но углекислый газ и вода также содержат кислород, массу которого следует вычесть.

моль

грамм

моль

грамм
Соответственно,

грамм.
Определим массу углекислого газа:

грамм
Тогда масса алкина равна:

грамм
Представим молярную массу алкина следующим образом:

Далее я, судя по всему, полез не в ту степь:



В итоге
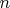
оказалась приблизительно равна 1,3.
Но так, насколько я теперь понимаю, нельзя делать, ведь в уравнении реакции неизвестны коэффициенты правой и левой частей. Точнее, в левой-то наверняка единица, а в правой - неизвестно что перед углекислым газом и водой.
3) 3-й способ был основан на столь же некорректном приравнивании отношения массы алкина к молярной массе и отношений объёма и молярного объёма углексилого газа, массы и молярной массы воды. Решил полученную системку, но толку нет, ведь это изначально неверно.