Добрый день!
Во время лабораторной делали такую реакцию:

, причем раствор не подкисляли и не подщелачивали.
В результате, очевидно, получилась бурная реакция распада пероксида на кислород, образовался также коричневый оксид марганца (IV). Как объяснить с точки зрения стандартных восстановительных потенциалов эту реакцию, если:

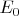
=0.621 В

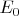
=0.694 В
Получается, что

и реакция не должна идти!
Как объяснить тогда протекание этой реакции?