1) выписываем соответствующие полуреакции, находим число электронов:


Наименьшее общее кратное 3 и 5 равно 15. Соответственно, первую полуреакцию домножаем на
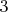
, вторую на
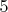
. Далее складываем как это делаем при решении системы алгебраических уравнений:

сокращаем подобные члены, объединяем нужные ионы и получаем

2)

и

. Атом фосфора в основном состоянии имеет электронную конфигурацию

. Поэтому есть три неспаренных электрона. Мне кажется, в

нет гибридизации, т.к. в образовании трех одинаковых связей принимают участие три
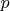
-электрона, а они равнозначны по энергии. В

атом фосфора в возбужденном состоянии, происходит перескок одного

-электрона на вакантную
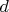
-орбиталь. Соответственно,
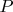
в

-гибридизации.
В пропане атом углерода в возбужденном состоянии. В основном состоянии электронная конфигурация

. Для образования ковалентных связей нужны четыре одинаковые атомные орбитали. Это получается в результате перескока

-электрона на вакантное место на

-орбитали. В итоге имеем атом углерода в

-гибридизованном состоянии
3) эквивалентная масса соли - это произведение фактора эквивалентности на молярную массу. В свою очередь, фактор эквивалентности для соли:

,
где

-число атомов металла

-валентность металла.
Дальше с помощью арифметики и таблицы Мендеелева справитесь самостоятельно. Если будут вопросы - отвечу