Прошу прощения, если я не очень понятно объясняю - по образованию я не физик и не химик. Моя задача чисто теоретическая - при чтении учебников возникла мысль, что изобарно-изотермическая задача (с потенциалом Гиббса), изохорно-изотермическая (с потенциалом Гельмгольца) и вообще все изо-задачи есть частные постановки одной общей задачи. Вот и хочу попробовать решить задачу не при постоянных давлении или объеме, а при связанных, тогда все изо-задачи будут просто ее частным случаем. Начал с самого простого варианта, потом попробую усложнить.
С якобианами у Вас как?Тут как раз все просто - современные матпакеты способны брать производные и от векторных функций
Кстати, вы случайно не химик, у них вроде как такая сильная любовь к переменным 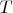 и
и 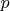 (на решение задачи это отразится только в рассмотрении, например, не свободной энергии, а потенциала Гиббса)?
(на решение задачи это отразится только в рассмотрении, например, не свободной энергии, а потенциала Гиббса)?Никакой любви нет, наоборот, как раз хотелось бы избежать частных постановок.
Далее до чего пока дошел. Если возможно, подскажите, пожалуйста, насколько правомочно такое решение.
В общем виде имеем:
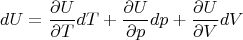
 есть большое подозрение, что для идеального газа последние два слагаемых равны нулю, но пока оставим
есть большое подозрение, что для идеального газа последние два слагаемых равны нулю, но пока оставимЕще уравнение состояния идеального газа и уравнение, связывающее давление с объемом в виде

- для простоты назовем их связывающими уравнениями (не знаю, как правильно назвать). В качестве независимой переменной выбираем, к примеру, давление. Из связывающих уравнений находим

и

. Подставляем это в уравнение для дифференциала внутренней энергии. Частные производные остаются на месте, меняются только полные дифференциалы, а именно

и

. Точно так же меняется полный дифференциал объема в уравнении для

. Далее подставляем внутреннюю энергию в уравнение теплоты, и с учетом

,

и

имеем:

Интегрируя

находим

, и, используя связывающие уравнения

и

.