Я хотел повторить вывод уравнения Клапейрона — Клаузиуса и уравнения кривой равновесия водяной пар — жидкость с учётом наличия в системе воздуха.
Модельная системаСистема состоит из двух фаз: газообразной и жидкой. Жидкая фаза представлена водой, способной испаряться. Ее молярный объем —

, молярная энергия Гиббса —

.
Газообразная фаза представлена водяным паром, способным конденсироваться в жидкость, а также воздухом. Давление, создаваемое молекулами воздуха назовём

и положим неизменным, парциальное давление водяного пара —

, молярную энергию Гиббса газообразной фазы —

, молярный объем газообразной фазы —

.
Химическое количество веществ в системе остаётся неизменным.
ВыводВыражение для общей энергии Гиббса системы при одинаковом во всей системе давлении

и температуре
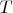
:

(

— химическое количество жидкости, или пара, или воздуха, в соответствии с индексом)
При процессах конденсации и испарения общая энергия Гиббса изменяется за счёт изменения количества жидкости и ее пара. Воздух не переходит из одной фазы в другую, следовательно,

постоянно.
Таким образом, изменение общей энергии Гиббса при малых изменениях количества жидкости/пара:

Кроме того, изменение количества пара влечет за собой обратное по знаку изменение количества жидкости:

С учётом этого:

При постоянных давлении и температуре в системе, процессы будут происходить в сторону уменьшения энергии Гиббса. Таким образом, в случае неравенства

и

будут происходить фазовые превращения. Равновесие возможно лишь в случае

.
Вдоль всей кривой равновесия это условие выполняется, то есть

, то есть:

Так как

на всей кривой постоянно:

Преобразуем выражение с учётом того, что изменение энтропии при изотермическом переходе одного моля жидкости в газ есть

, где
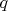
— молярная теплота изотермического перехода жидкость—газ,
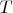
— температура перехода:


Запишем уравнение Менделеева-Клапейрона для 1 моля газовой фазы и выразим из него ее молярный объем:


Подставим в предыдущее уравнение, допустив для упрощения, что

:


Решим полученное дифференциальное уравнение:



Пусть при

и

система находится в равновесии.




Так как

в данном выражении - давление пара жидкости в состоянии фазового равновесия (т.е. давление насыщенного пара), выходит, что давление насыщенного пара зависит не только от температуры, но ещё и от давления смешанного с паром воздуха, что, мне кажется, всё-таки неверно. В чем ошибка?