Термодинамика не говорит, что "система перейдёт в равновесное состояние только при максимальной энтропии" или что "Для равновесия должно выполняться

" --- оба эти утверждения неверны. Термодинамика говорит только, что если для некоторой системы возможны два равновесных состояния с энтропиями

и

, причем

, то самопроизвольный переход (т.е. такой, при котором никаких изменений в телах, не входящих в систему, не произошло) из состояния 1 в состояние 2 невозможен. Не больше и не меньше. Термодинамика может только запретить некоторый переход, но если некоторый переход термодинамикой не запрещен, то это отнюдь не означает, что он обязательно произойдет, скажем, за время жизни вселенной. Реализуемость каждого конкретного допустимого термодинамикой перехода определяется кинетикой конкретной системы, никакой универсальности здесь нет. Вообще, когда говорят, что энтропия изолированной системы достигает максимума, имеют в виду утверждение типа такого: если система помещена в жесткую адиабатическую оболочку (тем самым фиксируются два термодинамических параметра
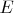
и

, которые, как показывает опыт, в простейшем случае химически однородного газа полностью определяют его макроскопическое состояние) и вдобавок к этому в системе есть ещё некоторый внутренний параметр

, изменение которого приводит к изменению равновесного (обычно метастабильного, но могущего рассматриваться как равновесное на интересующем масштабе временных интервалов при рассматриваемых условиях) состояния системы, то самым устойчивым (в том смысле, что система не может самопроизвольно уйти из него) является состояние с

, при котором функция

принимает максимально возможное значение. Однако при этом никаких утверждений относительно свойств дифференциала

в равновесных состояниях, отвечающих разным значениям параметра

, не делается. Например, пусть у нас есть (метастабильная) газовая смесь кислорода, водорода и водяного пара, заключенная в жесткую адиабатическую оболочку. Внутренним параметром

здесь является концентрация водяного пара. Ясно, что

--- монотонно возрастающая функция

, но при отсутствии заметных внешних воздействий система может сколь угодно долго находиться в равновесном состоянии с любым

, т.е. в равновесном состянии, в котором

.