Здравствуйте, форумчане!
Такой вопрос: В учебнике разбирается задача
Протекает квазистатический процесс: идеальный газ, имеющий давление
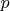
занимает часть

теплоизолированного сосуда некоторого объёма

. Другая часть сосуда не содержит газа и отделена от заполненной части поршнем. За поршнем на равном расстоянии
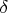
друг от друга расположены задвижки. В процессе происходит последовательное отодвигание задвижек с выжиданием установления равновесия. И так до момента полного заполнения сосуда. Таким образом, устанавливается серия равновесных состояний, соединяющая начальную и конечную точку процесса. А процесс в целом можно рассматривать как квазистатический.
Утверждается, что обмен теплом и работой отсутствуют, а изменение энтропии на каждом подскоке при отодвигании задвижки в процессе составит

.
Вопрос:
Ранее в учебнике давались 0, 1 и 2 начало термодинамики.
Согласно 1 началу

Согласно 2 началу

.
Но раз обмена теплотой нет, то значит и энтропия должна быть нулевой. Откуда же выводится значение энтропии в данном случае? Поясните, пожалуйста