Вопрос такой: как связать между собой потенциал в физике (как отношение потенциальной энергии заряда к величине заряда) и потенциал в химии (например, стандартный окислительно-восстановительный потенциал (редокс-потенциал))?
Например, есть 2 реакции:

, её стандартный редокс-потенциал


, её стандартный редокс-потенциал

Чтобы выяснить, кто в этой паре будет окислителем, кто восстановителем при составлении из них гальванического элемента, ищут стандартную ЭДС - разность стандартных редокс-потенциалов двух окислителей:

реакция
 самопроизвольно
самопроизвольно в этой паре не пойдёт.

реакция
 самопроизвольно
самопроизвольно в этой паре пойдёт.
Тогда
1) при разрядке гальванического элемента в процессе его работы:
Катод:

Анод:

2) при зарядке гальванического элемента в процессе электролиза:
Катод:

Анод:

Вот график из физики для изменения потенциала внутри гальванического элемента и во внешней цепи:
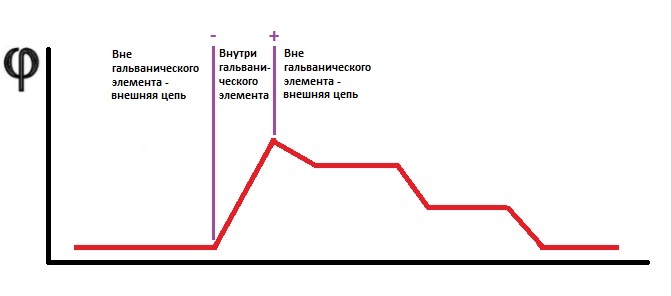
Отсюда ещё вопрос: почему стандартная ЭДС - это разность стандартных редокс потенциалов двух окислителей

, а не восстановителя и окислителя

? Неясно, потому что у нас же один элемент всё таки восстанавливается

, а второй элемент окисляется

, поэтому на катоде будет потенциал восстанавливающегося окислителя

, а на аноде будет потенциал окисляющегося восстановителя

и тогда разность потенциалов должна быть

Понимаю, что в реальности наоборот: сначала измеряют ЭДС, а затем высчитывают стандартный электродный потенциал относительно стандартного водородного электродного потенциала, принятого условно за 0, но всё же неясен расчёт по формуле с разностью потенциалов двух окислителей.