Здравствуйте.
Читала Румера, Рывкина "Термодинамика, статистическая физика и кинетика". В параграфе "Многокомпонентные системы. Правило фаз" выводится, собственно, правило фаз Гиббса. Рассматривается система из
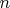
компонентов. Ставится вопрос, сколько фаз одновременно могут находится в равновесии в такой системе. Правило фаз выводится исходя из того, что состояние системы характеризуется температурой
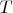
и давлением
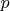
(одинаковыми для всех фаз вследствие механического и теплового равновесия) и концентрацией каждого компонента в каждой фазе

, где
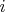
--- номер компонента,
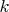
--- номер фазы. Для каждой фазы число независимых концентраций равно

. Таким образом, для

фаз полное число независимых переменных, описывающих систему, равно

. Химическое равновесие задается

уравнениями для химических потенциалов. Таким образом,

переменных связаны

уравнениями. Число степеней свободы, т.е. параметров, которые можно изменять, не нарушая условия равновесия равно

. По своему смыслу

, следовательно,

. Т.е. в системе из
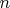
компонентов в равновесии может находится не более, чем

фазы.
Далее рассматривается пример для однокомпонентной системы. Правило фаз принимает вид

, что соответствует равновесию в тройной точке с фиксированными давлением и температурой (концентрация одного компонента в каждой фазе, очевидно, равна
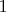
). Но затем говорится, что
Цитата:
... значения

возможны в принципе (например, равновесие жидкой, газообразной и двух твердых фаз), но запрещены правилом фаз Гиббса.
И вот этот момент мне не совсем понятен. Подразумевается, что
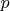
и
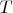
могут удовлетворять не только двум уравнениям связи (

,

), но и трем (

,

,

)?